题目内容
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是_____________________________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为________。证明炉渣中含有FeO的实验现象为_______________________。
【答案】 Cu、O b、c Al3++4OH-===AlO![]() +2H2O 稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
+2H2O 稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
【解析】(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;(2)冶炼过程产生大量SO2。分析下列处理方案:a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,选项a错误; b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,选项b合理;c.用纯碱溶液吸收二氧化硫可以制Na2SO4,选项c合理;d.用浓硫酸不能吸收二氧化硫,选项d不合理;答案选b、c;(3)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++Al2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成四羟基合铝,故答案为:Al3++4OH-=2H2O+AlO2-;b.高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色。

 阅读快车系列答案
阅读快车系列答案【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。
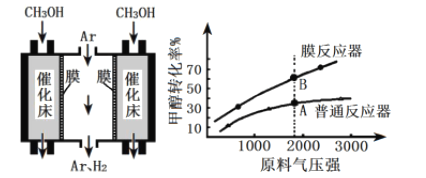
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______v逆(填“>”、“ =”、“ <”),理由是____________;
②B点比A点转化率高的原因是_______________。
(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g)![]() H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
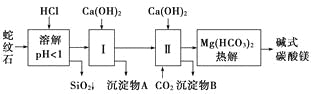
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______________________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。
【题目】将溶液(或气体)Y逐滴加入(或通入)一定量的溶液X中(下表),产生沉淀的物质的量(用纵坐标表示)与加入Y物质的量(用横坐标表示)的关系如图所示,则符合图中所示关系的一组物质是

A | B | C | D | |
X |
|
|
|
|
Y |
|
| NaOH | HCl |
A.AB.BC.CD.D
【题目】某学习小组探究 Mg 与 NaHCO3 溶液反应的机理,做了如下探究。
实验一:
实验 A | 实验 B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜), 吸入 15mL 饱和 NaHCO3 溶液。 | 在注射器中加入过量镁片(擦去表面 氧化膜),吸入 15mL 蒸馏水。 |
现象 | 有气体产生,20min 后注射器内壁和底部产生 大量白色沉淀 | 缓慢产生气体 |
(1)写出 B 中生成气体的化学方程式_____。
实验二:
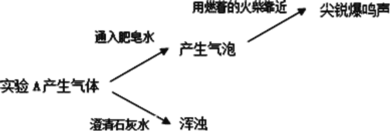
(2)实验 A 产生的气体有_____。
实验三:分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴 BaCl2 溶液,A 中立即产生白色沉淀,B 中无明显现象。
(3)实验三说明 Mg 与 NaHCO3 溶液反应产生了_____(填离子符号)。对 A 中白色固体的成分提出假设:
I.白色固体是 Mg(OH)2;II.白色固体是 MgCO3;III.白色固体是碱式碳酸镁。
实验四:
将 A 中白色沉淀过滤、洗涤后,取 0.1mol 加入 1mol/L 盐酸 800mL 恰好完全反应,产生标况下的 CO2 气体 6.72L。
(4)白色沉淀的主要成分为_____(写化学式)。
(5)综上所述,结合平衡移动原理解释实验 A 中产生现象的原因____________________________。