题目内容
【题目】(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
①下列可判断反应达平衡状态的是___________(填序号字母)。
A. 混合气体的平均相对分子质量不变 B. 混合气体密度保持不变
C. NO和Cl2的物质的量之比保持不变 D. 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_________(填选项序号字母)。
A. 升高温度 B. 缩小容器体积 C. 再充入Cl2气体 D. 使用合适的催化剂
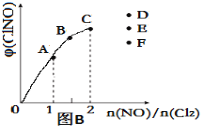
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(B)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是下图中D、E、F三点中的________点。
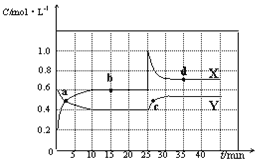
(2) 在体积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
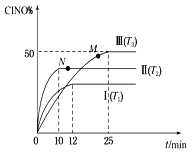
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是__________________。
②实验Ⅲ反应至25 min达到平衡,用NO物质的浓度变化表示的反应速率为__________________。达到平衡时,若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为________。
【答案】AC BC F 加入催化剂 0.008 mol·(L·min)-1 2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH = -Q KJ/mol
2ClNO(g) ΔH = -Q KJ/mol
【解析】
(1)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的其它物理量不变;
②提高NO的转化率即改变条件反应正向进行,提高反应速率可采取增大浓度、升高温度、加入催化剂、压缩气体,综合两方面解答;
③当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当![]() =2.5时产物的含量减小;
=2.5时产物的含量减小;
(2) ①结合影响反应速率和平衡移动的常见因素温度、压强和催化剂分析;
②实验Ⅲ反应至25 min达到平衡 2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始浓度(mol/L) 0.3 0.2 0
变化浓度(mol/L) 2c c 2c
起始浓度(mol/L) 0.3-2c 0.2-c 2c
平衡时ClNO%的含量为50%,则![]() 100%=50%,c=0.1,根据v=
100%=50%,c=0.1,根据v=![]() 计算用NO物质的浓度变化表示的反应速率;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,由此写出该反应的热化学方程式。
计算用NO物质的浓度变化表示的反应速率;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,由此写出该反应的热化学方程式。
(1)①A.反应2NO(g)+Cl2(g)![]() 2ClNO(g)是体积变化的反应,反应正向进行则气体总物质的量n减小,逆向进行则气体总物质的量n增大,体系中物质总质量m不变,结合M=
2ClNO(g)是体积变化的反应,反应正向进行则气体总物质的量n减小,逆向进行则气体总物质的量n增大,体系中物质总质量m不变,结合M=![]() 可知,M不变则各物质的物质的量不变,反应达到平衡状态,故A正确;
可知,M不变则各物质的物质的量不变,反应达到平衡状态,故A正确;
B.反应体系是恒容,各物质均为气态,所以气体的总质量不变,根据ρ=![]() 可知,体系中混合气体密度始终不变,即混合气体密度不变不能判定反应是否达到平衡,故B错误;
可知,体系中混合气体密度始终不变,即混合气体密度不变不能判定反应是否达到平衡,故B错误;
C.起始投入的NO与Cl2的物质的量之比是1:1,而变化的NO与Cl2的物质的量之比是2:1,所以在未达平衡前,NO与Cl2的物质的量之比是变化的,当NO与Cl2的物质的量之比保持不变时,反应达到平衡状态,故C正确;
D.v(ClNO)正=v(NO)正时,反应正向进行,不能确定是否达到平衡状态,故D错误;
故答案为AC;
②A.升高温度,反应速率加快,平衡会移动,但不知道反应的热效应,无法确定平衡移动的方向,故A错误;
B.缩小容器体积,相当加压,反应正向进行、反应速率加快,故B正确;
C.充入Cl2气体,反应速率加快、反应正向进行,NO的转化率提高,故C正确;
D.使用合适的催化剂,能加快反应速率,但不影响反应移动方向,即NO的转化率不变,故D错误;
故答案为BC;
③当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当![]() =2.5时ClNO的体积分数减小,所以应该是F点;
=2.5时ClNO的体积分数减小,所以应该是F点;
(2) 根据ClNO的百分含量随时间的变化的图示,T1>T2>T3,则升高温度,ClNO%不断减小,平衡逆向移动,说明正反应放热,即ΔH<0;
①与实验Ⅰ相比,实验Ⅱ的反应温度T2<T1,如果其它条件相同,实验Ⅱ达到平衡所需要的时间应该比实验Ⅰ长,而图示实验Ⅱ达到平衡所需要的时间应该比实验Ⅰ短,实验Ⅱ的反应速率快,则可能使用了催化剂;
②实验Ⅲ反应至25 min达到平衡

平衡时ClNO%的含量为50%,则![]() 100%=50%,c=0.1,则用NO物质的浓度变化表示的反应速率v(NO)=
100%=50%,c=0.1,则用NO物质的浓度变化表示的反应速率v(NO)=![]() =
=![]() =0.008 mol·(L·min)-1;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,则该反应的热化学方程式为2NO(g)+Cl2(g)
=0.008 mol·(L·min)-1;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,则该反应的热化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH = -Q KJ/mol。
2ClNO(g) ΔH = -Q KJ/mol。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
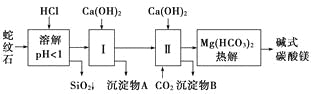
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______________________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。
【题目】某学习小组探究 Mg 与 NaHCO3 溶液反应的机理,做了如下探究。
实验一:
实验 A | 实验 B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜), 吸入 15mL 饱和 NaHCO3 溶液。 | 在注射器中加入过量镁片(擦去表面 氧化膜),吸入 15mL 蒸馏水。 |
现象 | 有气体产生,20min 后注射器内壁和底部产生 大量白色沉淀 | 缓慢产生气体 |
(1)写出 B 中生成气体的化学方程式_____。
实验二:
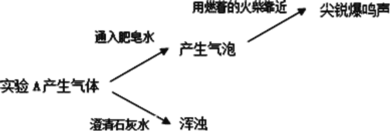
(2)实验 A 产生的气体有_____。
实验三:分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴 BaCl2 溶液,A 中立即产生白色沉淀,B 中无明显现象。
(3)实验三说明 Mg 与 NaHCO3 溶液反应产生了_____(填离子符号)。对 A 中白色固体的成分提出假设:
I.白色固体是 Mg(OH)2;II.白色固体是 MgCO3;III.白色固体是碱式碳酸镁。
实验四:
将 A 中白色沉淀过滤、洗涤后,取 0.1mol 加入 1mol/L 盐酸 800mL 恰好完全反应,产生标况下的 CO2 气体 6.72L。
(4)白色沉淀的主要成分为_____(写化学式)。
(5)综上所述,结合平衡移动原理解释实验 A 中产生现象的原因____________________________。