题目内容
【题目】五氧化二钒常用作化学工业中的催化剂,广泛用于冶金、化工生产。一种以钒渣(主要含有V2O3,还有少量FeO、Al2O3、SiO2等)为原料生产V2O5的工艺流程如图:

已知:VO![]() +H2O
+H2O![]() VO
VO![]() +2H+
+2H+
(1)“焙烧”时,V2O3转化为NaVO3的化学方程式是___。
(2)滤渣1为___(填化学式),“酸浸”后,调pH=7.6,除了得到沉淀Fe(OH)3、___,另一个目的是___。
(3)“沉钒”得到偏钒酸铵(NH4VO3)的离子方程式是___。图1是沉钒率随温度的变化曲线,温度高于80℃,沉钒率下降,其可能原因是___。
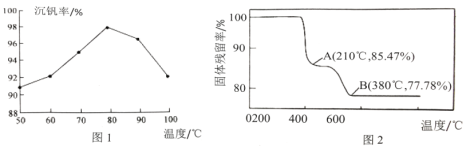
(4)在“煅烧”过程中,固体残留率(剩余固体质量/原始固体质量x100%)随温度变化的曲线如图2所示。NH4VO3分解过程中,先后失去的物质分别是___、___。(填化学式)
(5)金矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+![]() VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
VO2++H2O+V3+,电池充电时,阳极的电极反应式为___。
【答案】V2O3+Na2CO3+O2![]() 2NaVO3+CO2 H2SiO3 Al(OH)3 使VO
2NaVO3+CO2 H2SiO3 Al(OH)3 使VO![]() +H2O
+H2O![]() VO
VO![]() +2H+平衡正向移动,VO
+2H+平衡正向移动,VO![]() 更多的转化为VO
更多的转化为VO![]() NH
NH![]() +VO
+VO![]() =NH4VO3↓ 温度高于80℃,NH
=NH4VO3↓ 温度高于80℃,NH![]() 水解程度增大成为主要因素,使NH
水解程度增大成为主要因素,使NH![]() 浓度减小,沉钒率下降或温度升高NH4VO3溶解度增大或温度升高铵盐分解 NH3 H2O VO2++H2O-e-=VO
浓度减小,沉钒率下降或温度升高NH4VO3溶解度增大或温度升高铵盐分解 NH3 H2O VO2++H2O-e-=VO![]() +2H+
+2H+
【解析】
钒渣(主要含有V2O3,还有少量FeO、Al2O3、SiO2等)混合碳酸钠在空气中焙烧,V2O3转化为NaVO3同时铁元素被氧化、SiO2转化为Na2SiO3;再用足量稀硫酸浸取,得到的溶液中主要含有VO![]() 、Fe3+、Al3+,滤渣1为不溶于稀硫酸的H2SiO3;之后调节溶液pH值使Fe3+、Al3+转化为沉淀,滤渣2主要为Fe(OH)3、Al(OH)3,同时pH增大使VO
、Fe3+、Al3+,滤渣1为不溶于稀硫酸的H2SiO3;之后调节溶液pH值使Fe3+、Al3+转化为沉淀,滤渣2主要为Fe(OH)3、Al(OH)3,同时pH增大使VO![]() +H2O
+H2O![]() VO
VO![]() +2H+平衡正向移动;之后加入硫酸铵得到NH4VO3沉淀,过滤煅烧沉淀得到V2O5。
+2H+平衡正向移动;之后加入硫酸铵得到NH4VO3沉淀,过滤煅烧沉淀得到V2O5。
(1)V2O3与碳酸钠混合在空气中煅烧,转化为NaVO3的过程中V元素被氧气氧化,根据电子守恒和元素守恒可得化学方程式为V2O3+Na2CO3+O2![]() 2NaVO3+CO2;
2NaVO3+CO2;
(2)滤渣1为不溶于稀硫酸的H2SiO3;根据分析可知调pH=7.6,得到的沉淀有Fe(OH)3、Al(OH)3,pH增大使VO![]() +2O
+2O![]() VO
VO![]() +2H+平衡正向移动,VO
+2H+平衡正向移动,VO![]() 更多的转化为VO
更多的转化为VO![]() ;
;
(3)沉钒过程发生复分解反应,离子方程式为NH![]() +VO
+VO![]() =NH4VO3↓;铵根在水溶液中会发生水解,水解为吸热反应,温度高于80℃,NH
=NH4VO3↓;铵根在水溶液中会发生水解,水解为吸热反应,温度高于80℃,NH![]() 水解程度增大成为主要因素,使NH
水解程度增大成为主要因素,使NH![]() 浓度减小,沉钒率下降;同时温度升高NH4VO3溶解度增大;且铵盐不稳定,温度升高铵盐分解;
浓度减小,沉钒率下降;同时温度升高NH4VO3溶解度增大;且铵盐不稳定,温度升高铵盐分解;
(4)根据铵盐的性质,NH4VO3分解产生氨气和HVO3,根据题意可知HVO3又分解产生V2O5;假设初始NH4VO3的质量为117g,物质的量为1mol,根据元素守恒可知分解过程中会产生1molNH3和0.5molH2O;A点减少的质量为117g×(1-85.47%)=17g,刚好是1molNH4VO3中的NH3,所以起点到A点失去的物质是NH3;A点到B点减少的质量为117g×(85.47%-77.78%)=9g,刚好是0.5molH2O的质量,所以A到B失去的是H2O;
(5)充电时阳极失电子发生氧化反应,根据电池总反应可知,阳极的电极反应式为VO2++H2O-e-=VO![]() +2H+。
+2H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入______________________________________________________________(填入物质的化学式),
然后______________________________________________________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________________________________________________________________________
④________________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________,b=________,c=________。
【题目】某学习小组探究 Mg 与 NaHCO3 溶液反应的机理,做了如下探究。
实验一:
实验 A | 实验 B | |
操作 | 在注射器中加入过量镁片(擦去表面氧化膜), 吸入 15mL 饱和 NaHCO3 溶液。 | 在注射器中加入过量镁片(擦去表面 氧化膜),吸入 15mL 蒸馏水。 |
现象 | 有气体产生,20min 后注射器内壁和底部产生 大量白色沉淀 | 缓慢产生气体 |
(1)写出 B 中生成气体的化学方程式_____。
实验二:

(2)实验 A 产生的气体有_____。
实验三:分别取少量实验 A 和 B 的上层清液于两支试管中,各加入 2 滴 BaCl2 溶液,A 中立即产生白色沉淀,B 中无明显现象。
(3)实验三说明 Mg 与 NaHCO3 溶液反应产生了_____(填离子符号)。对 A 中白色固体的成分提出假设:
I.白色固体是 Mg(OH)2;II.白色固体是 MgCO3;III.白色固体是碱式碳酸镁。
实验四:
将 A 中白色沉淀过滤、洗涤后,取 0.1mol 加入 1mol/L 盐酸 800mL 恰好完全反应,产生标况下的 CO2 气体 6.72L。
(4)白色沉淀的主要成分为_____(写化学式)。
(5)综上所述,结合平衡移动原理解释实验 A 中产生现象的原因____________________________。