题目内容
据报道,N4是一种形似白磷的分子,18O2是比黄金还贵重的物质。下列说法正确的是
| A.18O2与16O2性质完全相同 | B.N4=2N2是化学变化 |
| C.N4和N2互为同位素 | D.18O2中含18个中子 |
B
解析试题分析:A.18O2 与16O2 因组成的原子是不同种原子,因此分子的摩尔质量不同,物理性质不同,但是化学性质几乎完全相同。错误。B.N4=2N2因为有新的物质分子形成,所以该变化是化学变化。正确。C. N4和N2是N元素形成的不同性质的单质,二者是同素异形体。错误。D.在一个18O2中含有的中子数是10×2=20.错误。
考点:考查同位素、同素异形体的概念、应用级性质的知识。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
下列各组顺序的排列不正确的是( )
| A.原子半径:Na>Mg>Al>H | B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 | D.氧化性:K+<Na+<Mg2+<Al3+ |
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、 Z的说法正确的是 ( )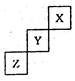
| A.相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B.由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
| C.ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D.Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
已知质量数为A的某阴离子Rn-,核外有x个电子,则核内中子数为( )
| A.A- x |
| B.A-x-n |
| C.A-x+n |
| D.A+x-n |
下列叙述正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
| D.IA族与VIIA族元素间形成的化合物,有共价化合物也有离子化合物 |
国外科学家曾将铅(Pb)和氪(Kr)两种元素的原子核对撞,获得了一种质子数为118、
质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
| A.47 | B.57 | C.61 | D.175 |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| | R | |
| X | T | Z |
| | Q | |
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q