题目内容
已知质量数为A的某阴离子Rn-,核外有x个电子,则核内中子数为( )
| A.A- x |
| B.A-x-n |
| C.A-x+n |
| D.A+x-n |
C
解析试题分析:阴离子Rn-核外有x个电子,说明R原子的电子数是x-n,即R的质子数是x-n,又R的质量数是A,所以核内的中子数是A-(x-n)=" A-x+n" ,答案选C。
考点:考查质子数、中子数、电子数、质量数的关系

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
关于原子结构、元素性质的说法正确的是
| A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.在化学反应中,原子首先失去的电子能量最低 |
| D.在元素周期表中,各主族元素的最高化合价与其族序数相等 |
下列叙述正确的是( )
| A.碱金属单质在空气中燃烧的生成物都是过氧化物 |
| B.少量的碱金属单质都能保存在煤油中 |
| C.HF、HCl、HBr、HI的稳定性、还原性从左到右依次减弱 |
| D.随着原子序数的递增,卤素单质的颜色由浅到深,熔沸点逐渐升高 |
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素。下面关于它的原子结构和性质预测正确的是
| A.类铅元素原子的最外层电子数为4 | B.其常见价态为+2、+3、+4 |
| C.它的金属性比铅弱 | D.它的原子半径比铅小? |
甲、乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合 ②甲原子能与乙阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低
| A.只有④ | B.只有⑤ | C.①②③ | D.①②③④ |
据报道,N4是一种形似白磷的分子,18O2是比黄金还贵重的物质。下列说法正确的是
| A.18O2与16O2性质完全相同 | B.N4=2N2是化学变化 |
| C.N4和N2互为同位素 | D.18O2中含18个中子 |
下图是周期表中短周期的一部分,A、C的原子序数之和等于B原子的原子序数。下列叙述正确的是
| A | | C |
| | B | |
A.B的氧化物对应的水化物一定为强酸,且只有氧化性
B.三种元素对应的氢化物中C的氢化物稳定性最好
C.原子半径大小关系为:C>A
D.C的单质常温下为无色无味的气体
X、Y、Z、W为四种短周期元素,它们在周期表中的位置如图所示。Z元素原子核外第一层与第三层电子数相等。下列说法不正确的是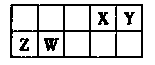
| A.与相同浓度的盐酸反应,Z单质比W单质更剧烈 |
| B.Y元素可以形成多种具有漂白性的化合物 |
| C.Y与Z、Y与W形成的化合物含有的化学键类型相同 |
| D.四种元素的离子半径大小为Z>W>X>Y |