题目内容
下列各组顺序的排列不正确的是( )
| A.原子半径:Na>Mg>Al>H | B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 | D.氧化性:K+<Na+<Mg2+<Al3+ |
B
解析试题分析:A.Na、Mg、Al是第三周期的元素,元素的原子序数越大,原子半径就越小。而H是第一周期的元素。元素的原子核外电子层数越多,原子半径就越大。所以原子半径:Na>Mg>Al>H。正确。B.元素的非金属性:Cl>S>P.亅的非金属性越强,其氢化物的稳定性就越强。因此热稳定性: HC l>H2S>PH3。错误。C.元素的非金属性:P>C>Si,元素的非金属性越强,其最高价的含氧酸的酸性就越强。所以酸性强弱:H2SiO3<H2CO3<H3PO4。正确。D.元素的金属性:K>Na>Mg>Al.元素的金属性越强,其离子与电子的结合力就越弱。即氧化性越弱。因此氧化性:K+<Na+<Mg2+<Al3+。正确。
考点:考查原子半径、离子的氧化性、元素的氢化物及最高价含氧酸的酸性强弱的比较的知识。

练习册系列答案
相关题目
下列物质的性质比较,正确的是
| A.酸性:H2SO4>HClO4>HBrO4 | B.碱性:NaOH>KOH>RbOH |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>H2O>PH3 |
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超重
元素,该元素原子核内中子数与核外电子数之差是( )
| A.57 | B.47 | C.61 | D.293 |
国际上不提倡伊朗浓缩铀,因为铀 是制造原子弹的燃料。
是制造原子弹的燃料。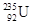 原子核内含有中子数为
原子核内含有中子数为
| A.92 | B.235 | C.143 | D.327 |
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是( )
| A.X的单质固态时为分子晶体 | B.Y的单质可以形成原子晶体 |
| C.X与Y形成的化合物固态时为分子晶体 | D.X与碳形成的化合物为分子晶体 |
关于原子结构、元素性质的说法正确的是
| A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.在化学反应中,原子首先失去的电子能量最低 |
| D.在元素周期表中,各主族元素的最高化合价与其族序数相等 |
据报道,N4是一种形似白磷的分子,18O2是比黄金还贵重的物质。下列说法正确的是
| A.18O2与16O2性质完全相同 | B.N4=2N2是化学变化 |
| C.N4和N2互为同位素 | D.18O2中含18个中子 |
下列化合物中,阴离子和阳离子的半径之比最大的是 ( )
| A.CsI | B.NaF | C.LiI | D.KCl |