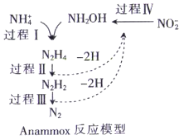
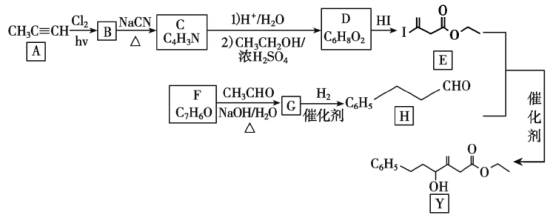
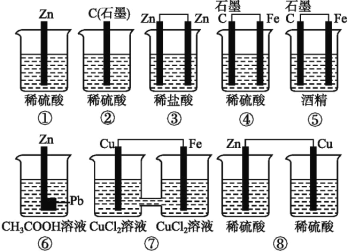
题目内容
【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
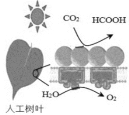
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
【答案】![]() 光能转化为化学能 2CO2+2H2O
光能转化为化学能 2CO2+2H2O![]() 2HCOOH+O2 ac 0.15mol·L-1·min-1 ade 放出 43
2HCOOH+O2 ac 0.15mol·L-1·min-1 ade 放出 43
【解析】
(1)二氧化碳为共价化合物,分子中C原子和O原子形成共价键,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)由二氧化碳制取甲酸(HCOOH)的转化途径可知,该过程主要是将光能转化为化学能,CO2和H2O在光照的条件下转化为甲酸,同时生成O2,其化学反应方程式为2CO2+2H2O![]() 2HCOOH+O2,故答案为:光能转化为化学能;2CO2+2H2O
2HCOOH+O2,故答案为:光能转化为化学能;2CO2+2H2O![]() 2HCOOH+O2;
2HCOOH+O2;
(3)①恒容容器中,对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)
a.升高温度,活化分子数增多,化学反应速率加快,a符合题意;
b.从体系中分离出CH3OH,浓度降低,化学反应速率减慢,b不符合题意;
c.加入高效催化剂,可降低反应活化能,化学反应速率加快,c符合题意;
d.压强减小,由于容器体积保持不变,所以各组分浓度不变,化学反应速率不变,d不符合题意;
故答案为:ac;
②根据图表信息可知,反应开始到5min末,共消耗1-0.5=0.5molCO2,由化学方程式CO2(g)+3H2(g)CH3OH(g)+H2O(g)可知,消耗的H2的物质的量为3×0.5mol=1.5mol,则用H2浓度变化表示的平均反应速率为 ,故答案为:0.15mol·L-1·min-1;
,故答案为:0.15mol·L-1·min-1;
③相同温度、恒容的条件下,对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)
a.CO2、H2、CH3OH、H2O的浓度均不再改变化,说明反应达到限度,即达到平衡状态,a满足题意;
b.当n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1时,不能说明化学反应达到平衡,b不满足题意;
c.容器体积不变,则容器中混合气体的密度始终是一个不变量,不能作为达到平衡的标志,c不满足题意;
d.当反应达到平衡时,正逆反应速率相等,化学反应速率与化学计量数成正比,因此v消耗(H2)=3v生成(CH3OH),即v消耗(H2)=3v消耗(CH3OH)时,v生成(CH3OH)=v消耗(CH3OH),说明反应达到平衡,d满足题意;
e.根据阿伏伽德罗定律PV=nRT可知,恒温恒压时,体系压强不变,则物质的量不变,反应为前后物质量不等的反应,故体系压强不变,即物质的量不变时,反应达到平衡,e满足题意;
故答案为:ade;
(4)根据ΔH=反应物的总键能-生成物的总键能可知,反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)
中,共断裂2molC=O键、3molH—H键,生成3molC—H键、1molC—O键和3molO—H,则ΔH=(2×803+3×436)-(3×414+326+3×463)=-43kJ/mol,即放出热量43kJ,故答案为:放出;43。

【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__________________________________________。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__________________________________。
(3)①甲同学认为:实验Ⅱ观察到__________________现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是___________________________________________________。
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为_____________。
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是___________。

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置