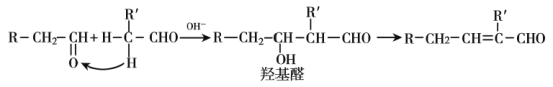
题目内容
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
|
|
|
|
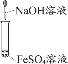
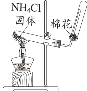
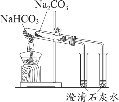
A证明醋酸酸性比 硼酸强 | B实验室制 氢氧化亚铁 | C实验室制氨气 | D证明碳酸氢钠热稳定 性比碳酸钠弱 |
A.AB.B…C.CD.D
【答案】A
【解析】
A. 碳酸钠加到醋酸中有气体生成,则醋酸酸性大于碳酸,碳酸钠加入到硼酸中无现象,说明碳酸酸性大于硼酸,则可得醋酸的酸性大于硼酸,故A正确;
B. 将氢氧化钠滴加到硫酸亚铁溶液中,可短暂生成氢氧化亚铁,但很快被空气中的氧气氧化生成氢氧化铁,若想制得氢氧化亚铁需满足无氧条件,例如加入苯等,故B错误;
C. 氯化铵受热分解生成氯化氢和氨气,生成的氨气和氯化氢又很快化合生成氯化铵固体小颗粒,无法得到氨气,故C错误;
D. 小试管内应放碳氢酸钠,温度较低的情况下碳酸氢钠分解产生二氧化碳使澄清石灰水变浑浊,大试管放碳酸钠,温度较高受热不分解,不能使澄清石灰水变浑浊,说明碳酸钠比碳酸氢钠稳定,故D错误;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__________________________________________。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__________________________________。
(3)①甲同学认为:实验Ⅱ观察到__________________现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是___________________________________________________。
(4)综合实验Ⅰ和Ⅲ,得出Cl2、Br2、I2氧化性由强到弱的顺序为_____________。
(5)实验室的氯水都是实验前新制备,其制备的方法是将氯气通往蒸馏水中使其充分溶解而得到。实验室可用如图装置来制备氯水,下列对于该实验说法正确的是___________。

A.甲装置中所用药品为浓盐酸和二氧化锰
B.若在装置乙、丙之间增加一个如图(a)所示装置,制备的氯水更纯净
C.为提高氯水的制备效率,可在丙装置中的长玻璃管下端接一个如图(b)所示的多孔球
D.为了充分吸收尾气并防止倒吸,丁装置可选用如图(c)所示装置
【题目】(1)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=____(取小数点后两位,下同)。
②该反应的正反应为___(填“吸”或“放”)热反应,实验2条件下平衡常数K=___。
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,达到平衡后下列措施中能使c(CH3OH)增大的是____。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1 mol CO2和3 mol H2