题目内容
【题目】下列说法正确的是
A. 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B. 室温下,pH=3的CH3COOH溶液与 pH=11的NaOH溶液等体积混合,溶液pH>7
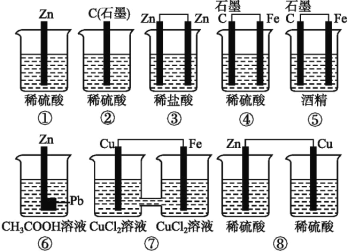
C. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D. 一定条件下反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
【答案】C
【解析】
A. H2O2分解产生1molO2,反应中O元素化合价由-1价升高到0价,转移2mol电子,因此转移的电子数目为2×6.02×1023,A错误;
B. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸是弱酸,在溶液中存在电离平衡,醋酸浓度大于NaOH浓度,醋酸过量,溶液pH<7,B错误;
C.钢铁水闸可用牺牲阳极的阴极保护方法或外加电流的阴极保护法防止其腐蚀,C正确;
D.一定条件下反应N2+3H2![]() 2NH3反应,速率关系符合系数比,即v正(H2):v正(NH3)=3:2,当反应达到平衡时,v正(NH3)=v逆(NH3),则达到平衡时,应为2v正(H2)=3v逆(NH3),D错误;
2NH3反应,速率关系符合系数比,即v正(H2):v正(NH3)=3:2,当反应达到平衡时,v正(NH3)=v逆(NH3),则达到平衡时,应为2v正(H2)=3v逆(NH3),D错误;
故合理选项是C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目