题目内容
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D
【答案】C
【解析】A.稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,强酸制取弱酸,所以酸性:硫酸>碳酸>硅酸,故A正确;B.浓盐酸和高锰酸钾溶液反应生成氯气,氯气能与Na2S溶液反应置换出硫单质,自发进行的同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,第一个反应中高锰酸钾作氧化剂、氯气是氧化产物,第二个反应中氯气是氧化剂、S是氧化产物,所以氧化性:KMnO4>Cl2>S,故B正确;C.常温下Cu和浓硫酸不反应,无SO2气体生成,故C错误;D.生石灰与浓氨水能够生成氨气,氨水为弱碱性,所以氨气通入AlCl3溶液中有Al(OH)3白色沉淀生成,能够得出该结论,故D正确;答案为C。

【题目】1.
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
窗体顶端
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成________而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_____。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,电解装置如下图所示。

①阴极上的产物是________ 。
②阳极生成Cu2O,其电极反应式为_________。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(5)肼又称联氨,易溶于水,是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因______。
(6)向1L恒容密闭容器中充入0.1molN2H4,在30℃、Ni-Pt催化剂作用下发生反应N2H4(g)![]() N2(g)+2H2(g),测得混合物体系中,
N2(g)+2H2(g),测得混合物体系中,![]() (用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。
(用y表示)与时间的关系如图所示。0-4min时间内H2的平均生成速率v(H2)=____mol/(L·min);该温度下,反应的平衡常数=_______。

(7)肼-空气清洁燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是_________。电池工作一点时间后,电解质溶液的pH将_______(填“增大”、“减小”、“不变”)。
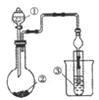
【题目】在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在_______式滴定管内,原因是(文字叙述并用有关离子方程式表示): ;若用甲基橙作指示剂,达到滴定终点时,溶液从_______色变为_______色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第______种(填序号)。
①2.500 mol/L ②0.25 mol/L ③0.025mol/L
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用C(Na2CO3)表示,滴定时实验数据列表如下:
实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
根据以上数据计算时应带入的Na2CO3溶液体积为_________,求这种待测盐酸的物质的量浓度(用数据和符号列式即可):C(HCl)=_________ 。
(4)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______(填“偏高”、“偏低”或“无影响”)。