题目内容
【题目】高纯硝酸锶Sr(NO3)2可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知:①“滤渣1”的成份为Ba(NO3)2、Sr(NO3)2 ②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是__________________,“滤液1”的主要溶质是_____________________。
(2)相对于水洗,用浓HNO3洗涤的优点是_____________________。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:_____________________________________________________。
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)_______________________________________________________。
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2” 溶液
溶液![]() 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为__________(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会_______(“偏高”、“偏低”或“无影响”)。
【答案】 避免HNO3挥发和分解,减少环境污染 Ca(NO3)2 减少硝酸锶(或“产品”) 溶解损失 4H2CrO4+3N2H4+12H+=4Cr3++3N2↑+16H2O 避免Cr(OH)3在碱性溶液中发生Cr(OH)3+OH-=CrO2-+2H2O而溶解 ![]() x100% 偏高
x100% 偏高
【解析】(1)“酸浸”不能采用高温的原因是避免HNO3挥发和分解,减少环境污染,工业级硝酸锶含硝酸钙、硝酸钡等杂质,利用浓硝酸酸浸后得到滤渣为Ba(NO3)2、Sr(NO3)2 ,则“滤液1”的主要溶质是Ca(NO3)2;(2)根据同离子效应,相对于水洗,用浓HNO3洗涤的优点是减少硝酸锶(或“产品”) 溶解损失;(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体氮气,根据氧化还原反应方程式的配平,则发生反应的离子方程式为4H2CrO4+3N2H4+12H+=4Cr3++3N2↑+16H2O;(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是避免Cr(OH)3在碱性溶液中发生Cr(OH)3+OH-=CrO2-+2H2O而溶解;(5)①酸性条件下BaCrO4与HI反应的离子方程式为2CrO42-+6I-+16H+=2Cr3++3I2+8H2O,结合反应I2+2S2O32-=2I-+S4O62-,则有:
2 BaCrO4~~~~~~~~~~ 3I2~~~~~~~~~~~~~~6S2O32-
2M 6
mg ![]() cV
cV ![]()
则![]() ;②若加入的HI溶液过量太多,部分HI被空气氧化,使测定结果偏高。
;②若加入的HI溶液过量太多,部分HI被空气氧化,使测定结果偏高。

【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_____________________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 _______。
A.c(H+)>c(OH-) B. c(H+)<c(OH-)
C.c(H+)+c(HCN) = C(OH-) D.c(HCN)+c(CN-)=0.01mol/L
(4)常温下,将某一元酸HA 和NaOH 溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸_____________。
②b组情况表明,c_______0.2(选填“大于”“小于”或“等于”)。混合溶液中离子浓度c(A-)________ c(Na+)(选填“大于”“小于”或“等于”)。
③a组实验所得混合溶液中由水电离出的c(OH-)=______molL-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______molL-1 。
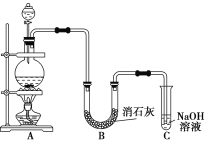
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 从食盐水中提取NaCl固体 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 mol·L-1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D