题目内容
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
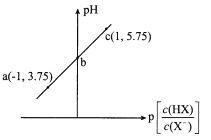
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
【答案】C
【解析】
电离平衡常数只受温度的影响,因此用a或c点进行判断,用a点进行分析,c(HX)/c(X-)=10-1,c(H+)=10-3.75mol·L-1,HX的电离平衡常数的表达式Ka=c(X-)×c(H+)/c(HX),代入数值,Ka=10-4.75,由于a、b、c均为酸性溶液,因此溶质均为“HX和NaX”,不可能是NaX或NaX和NaOH,pH<7说明HX的电离程度大于X-的水解程度,即只考虑HX电离产生H+对水的抑制作用,然后进行分析;
电离平衡常数只受温度的影响,因此用a或c点进行判断,假设用a点进行分析,c(HX)/c(X-)=10-1,c(H+)=10-3.75mol·L-1,HX的电离平衡常数的表达式Ka=c(X-)×c(H+)/c(HX),代入数值,Ka=10-4.75,由于a、b、c均为酸性溶液,因此溶质均为“HX和NaX”;
A、根据上述分析,pH<7说明HX的电离程度大于X-的水解程度,HX电离出H+对水电离起到抑制作用,H+浓度越小,pH越大,对水的电离抑制能力越弱,即溶液中水的电离程度:a<b<c,故A说法正确;
B、根据上述分析,HX的电离平衡常数Ka=10-4.75,b点时,c(HX)/c(X-)=1,则c(H+)=10-4.75mol·L-1,b点坐标是(0,4.75),故B说法正确;
C、c点溶液中c(Na+)+c(H+)=c(OH-)+c(X-),根据c点坐标,c(HX)/c(X-)=10,代入电荷守恒得到c(Na+)+c(H+)=c(OH-)+10c(HX),因为溶液显酸性,c(H+)>c(OH-),推出c(Na+)<10c(HX),故C说法错误;
D、根据上述分析,故D说法正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲、乙、丙、丁、戊、己六种有机物的化学式如下表所示:
物质 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
化学式 | CH4 | C2H4 | C3H8 | C4H8 | C2H6O | C2H4O2 |
下列与这些有机物有关的说法不正确的是
A. 甲、丙均不能使酸性高锰酸钾溶液褪色B. 丁的结构可能有5种(不考虑立体异构)
C. 等质量的乙、戊完全燃烧时耗氧量相等D. 己可能发生银镜反应而不发生水解反应






