题目内容
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D。
回答下列问题:
(1) C原子的价电子构型为csccpc+1 ,其中c为________, C原子的名称为__________ ;
(2)上述元素中,第一电离能最小的元素的原子结构示意图为__________________;
D的价电子排布图为______________________;E2D的电子式为__________________;
(3) 下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
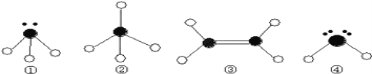
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________(填写分子的化学式);
②分子中的键角是_____________; 在③的分子中有_______个σ键和_______个π键。
【答案】2 氮 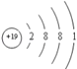
![]()
![]() NH3、CH4、H2S 109°28′ 5 1
NH3、CH4、H2S 109°28′ 5 1
【解析】
A元素的周期数、主族数、原子序数相同则A是H元素,B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同,即B为C元素,C原子的价电子构型为csccpc+1,其中s轨道排2个电子,即c=2,则C为N元素,D元素的原子最外层电子数比次外层电子数少2个,且D是短周期元素,所以D只能位于第三周期,即D是S元素,D的阴离子即S2-与E的阳离子电子层结构相同,D和E可形成化合物E2D,可推断出E的阳离子显+1价,则E为K;
(1) C原子的价电子构型为csccpc+1 ,其中s轨道排2个电子,即c=2,则C为氮元素;
故答案为:2,氮;
(2)上述元素中,第一电离能最小的是K元素,它的原子结构示意图为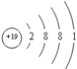 ,D为硫元素,S原子的价电子排布式为3s23p4,则S原子的价电子排布图为
,D为硫元素,S原子的价电子排布式为3s23p4,则S原子的价电子排布图为![]() ;E2D即K2S,它的电子式为
;E2D即K2S,它的电子式为![]() ;
;
故答案为: ,
,![]() ,
,![]() ;
;
(3) ①是NH3,中心原子N原子形成3个单键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,
②是CH4,中心原子形成4个单键,杂化轨道数为4,采取sp3杂化,其中键角为109°28′,
③是CH2=CH2中碳原子采取sp2杂化,形成平面结构,
④是H2S,中心原子形成2个单键,含有2对孤对电子,杂化轨道数为4,采取sp3杂化,
在③的分子中有2个单键、1个双键,单键为σ键,双键中有1个σ键、1个π键,故分子中含有5个σ键、1个π键,
故答案为:NH3、CH4、H2S,109°28′,5,1。

 走进文言文系列答案
走进文言文系列答案【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O