题目内容
【题目】NO2是形成雾霾天气的原因之一。
(1)重型车辆常在排气管内“喷淋”尿素[CO(NH2)2]溶液,使NO2转化为无污染物质。采用“喷淋”时,该反应的活化能____(选填“增大”“减小”“不变”),写出该反应的化学方程式:____。(已知:CO(NH2)2中N呈-3价)
(2)以CO2与NH3为原料可合成化肥尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式______。
(3)恒温下将1.6molNH3和0.8molCO2放入容积为8L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是______。
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1∶2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05mol·L-1。则平衡时CO2的转化率α=____;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率_____(选填“增大”“减小”“不变”)。
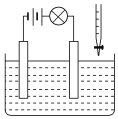
(4)为减少NO2排放,可将NO2转化为NO后通入如图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是_____。

【答案】不变 6NO2+4CO(NH2)2=7N2+4CO2+8H2O 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-276.0kJ/mol ac 50% 不变 8NO+2NH3+7H2O=5NH4NO3
【解析】
(1)尿素以喷淋的形式进入排气管,可增大与NO2气体的接触面积,加快了反应速率,但不改变反应的活化能;尿素与NO2反应生成CO2、N2和水的化学方程式是6NO2+4CO(NH2)2=7N2+4CO2+8H2O,故答案为:不变;6NO2+4CO(NH2)2=7N2+4CO2+8H2O;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-276.0kJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H=-276.0kJ/mol;
(3)a.反应前后气体反应物和生成物的系数和不等,正反应是体积减小的方向,在恒温恒容条件下,压强不变是平衡状态,选项a正确;
b.伴随反应的进行,CO2与NH3的速率之比始终为1:2,无法判断是平衡状态,选项b错误;
c.NH2CO2NH4(s)质量保持不变可说明是平衡状态,选项c正确;
d.反应在恒温条件下进行,无法判断是平衡状态,选项d错误;
2NH3+CO2NH2CO2NH4,
起始量(mol/L)0.2 0.1
变化量(mol/L)0.1 0.05
平衡量(mol/L)0.1 0.05
CO2的转化率=![]() ×100%=
×100%=![]() ×100%=50%,改变NH2CO2NH4(s)质量平衡不移动,CO2的转化率不变;
×100%=50%,改变NH2CO2NH4(s)质量平衡不移动,CO2的转化率不变;
故答案为:ac;50%;不变;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总电极反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,可知补充的A为NH3,使NO全部转化为NH4NO3,总化学反应方程式是8NO+2NH3+7H2O=5NH4NO3;
3NH4NO3+2HNO3,可知补充的A为NH3,使NO全部转化为NH4NO3,总化学反应方程式是8NO+2NH3+7H2O=5NH4NO3;
故答案为:8NO+2NH3+7H2O=5NH4NO3。