题目内容
【题目】下表代表周期表中的几种短周期元素,下列说法中错误的是
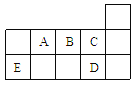
A. ED4分子中各原子均达8电子结构
B. AD3和ED4两分子的中心原子均为sp3杂化
C. A、B、C第一电离能的大小顺序为C>B>A
D. C、D气态氢化物稳定性强弱和沸点高低均为C>D
【答案】C
【解析】试题分析:根据短周期元素在周期表中的相对位置可判断A是N,B是O,C是F,D是Cl,E是Si。A.SiCl4分子中各原子均达8电子结构,A正确;B.NCl3和SiCl4两分子的中心原子的价层电子对数均是4,因此均为sp3杂化,B正确;C.非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,稳定性强,则A、B、C第一电离能的大小顺序为C>A>B,C错误;D.非金属性越强,氢化物的稳定性越强。又因为水分子间存在氢键,则C、D气态氢化物稳定性强弱和沸点高低均为C>D,D正确,答案选C。

【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的化学方程式为:___________________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在50~60℃时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,该反应的反应类型是_______________,化学方程式为___________________。
(4)C与D反应生成有香味的物质的化学方程式为: _______________,该反应的反应类型是_______________。
(5)B与液溴及铁反应的化学方程式为:__________, 生成有机物的名称是________。
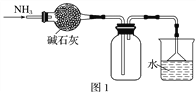
【题目】利用下图装置收集气体并验证其某些化学性质,正确的是

选项 | 气体 | 试剂② | 现象 | 结论 |
A | NH3 | 酚酞试液 | 溶液变红色 | NH3的水溶液显碱性 |
B | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
C | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
D | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |