题目内容
【题目】下列描述正确的是( )
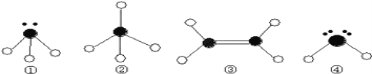
A. ClO3-的空间构型为平面三角形
B. SiF4和SO32-的中心原子均为sp2杂化
C. C2H2分子中σ键与π键的数目比为1︰1
D. SF6中有6对相同的成键电子对
【答案】D
【解析】
A.ClO3-的中心原子价层电子数为3+![]() =4,即Cl原子是sp3杂化,含有一个孤电子对,空间构型为三角锥形,故A错误;
=4,即Cl原子是sp3杂化,含有一个孤电子对,空间构型为三角锥形,故A错误;
B. SiF4的中心原子价层电子对数为4,为sp3杂化,SO32-的中心原子价层电子对数为4,为sp3杂化,故B错误;
C. C2H2分子中含有1个σ键与2个π键,所以σ键与π键的数目比为1︰2,故C错误;
D. SF6中价层电子对个数=6+![]() (66×1)=6,且不含孤电子对,所以有6对完全相同的成键电子对,故D正确;
(66×1)=6,且不含孤电子对,所以有6对完全相同的成键电子对,故D正确;
故选D。

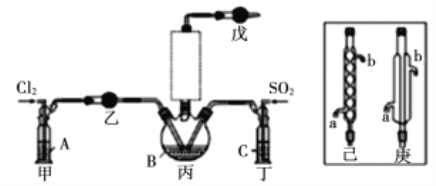
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:______________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_____________________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_________________________。
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_____________________________________________________。
②POCl3的质量分数为________________________。
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________(填“偏大”、“偏小”、“无影响”)。