题目内容
【题目】下列实验中,所选装置或实验设计合理的是
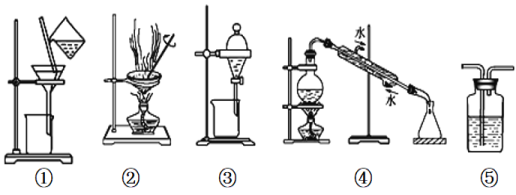
A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
【答案】A
【解析】
A. ①和②所示装置分别是过滤和蒸发,由于碳酸钙难溶于水,碳酸钠易溶于水,因此用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体,A正确;
B. 乙醇与水互溶,不能用乙醇提取溴水中的溴,B错误;
C. 不能用图④所示装置分离乙醇水溶液,因为缺少温度计,C错误;
D. 应该用饱和NaHCO3溶液除去CO2中含有的少量HCl,D错误。
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】下列各项中的物质,能满足如图中阴影部分关系的
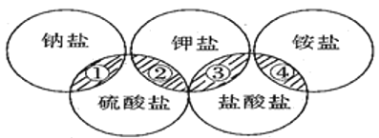
选项 | ① | ② | ③ | ④ |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | NaCl | K2SO4 | KCl | NH4Cl |
C | Na2SO4 | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A. A B. B C. C D. D
【题目】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。

(1)稀硫酸应放在___________中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关______、打开开关_______就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由_________________.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是__________________.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是__________。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为______________________.滴定终点的现象是_____________________.通过实验数据计算的该产品纯度为______________(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是_______。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低