题目内容
5.在研究物质变化时,不但要着眼于物质种类的变化,也要关注物质状态的变化.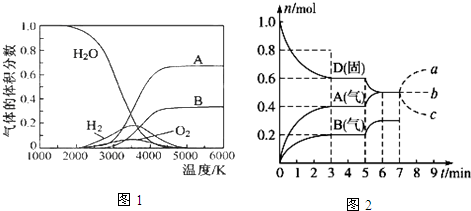
(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.
分析 (1)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍;根据是否断裂化学键判断其活化能;
(2)燃烧热是1mol氢气完全燃烧生成液态水放出热量,结合盖斯定律计算生成气态水蒸气放出热量,标注书写热化学方程式;
(3)①根据V=$\frac{△c}{△t}$进行计算;
②根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;
③增加固体的物质的量,浓度不变,平衡不移动;
(4)①压强从 200kPa 增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明a=b+c,改变压强平衡不移动;
②压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,所以平衡向“正向”移动.
解答 解:(1)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子;氧原子和氢原子生成水时不需要断裂化学键,所以其活化能=0,
故选C.
故答案为:C.
(2)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,②H2O(l)=H2O(g)△H=44KJ/mol
依据盖斯定律①+②得到H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;
(3)①从反应开始到第一次达到平衡时,A物质的平均反应速率为$\frac{\frac{0.4mol}{2.0L}}{3min}$=0.067mol/L•min,
故答案为:0.067 mol/(L•min);
②温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
故答案为:吸热;
③D为固体,增加D的物质的量,浓度不变,平衡不移动,故选:b;
故答案为:b;
(4)①根据表中数据,压强从 200kPa增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明浓度增大的倍数和压强增大的倍数相同,化学计量数满足a=b+c,改变压强化学平衡不移动,
故答案为:=;
②利用表中数据可知,压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,说明加压至1000kPa时,C物质变成了非气态物质,所以增大压强化学平衡向“正向”移动,
故答案为:正向,压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动;
点评 本题主要考查了化学平衡,平衡计算分析应用,化学反应的本质以及活化能等知识,掌握化学反应的本质是解题的关键,难度中等

 名校课堂系列答案
名校课堂系列答案| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、I-、NO3- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |
| A. | 氮原子结构示意图: | B. | 乙烯的结构式:CH2CH2 | ||
| C. | 含有10个中子的氧原子:${\;}_{10}^{18}$O | D. | 苯的结构简式: |
| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |
| A. | 在标准状况下,2.24L 苯中含有 0.6NA个碳原子 | |
| B. | 1 L PH=l的硫酸溶液中含有0.2NA个氢离子 | |
| C. | 1 L 1 mol•L-1的 FeC13溶液中,含有铁离子的数目为NA | |
| D. | t℃时,1 L pH=6的纯水中,含有10-6NA个OH- |
| A. | 向100mL 0.1mol•L-1 FeBr2溶液中通入0.012mol Cl2:10Fe2++14Br-+12Cl2═10Fe3++7Br2+24Cl- | |
| B. | 少量的铁与稀硝酸反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O | |
| C. | 铜与氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 过量二氧化碳通入澄清石灰水:Ca2++2OH-+CO2═CaCO3↓+H2O |
 短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: