题目内容
8.氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池.氢镍电池的总反应为$\frac{1}{2}$H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2.据此判断,下列叙述中正确的是( )| A. | 电池放电时,溶液中的阳离子移向正极 | |
| B. | 电池放电时,H2是正极 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,电池负极周围溶液的pH不断增大 |
分析 根据电池反应式知,放电时,负极反应为:H2-2e-+2OH-=2H2O,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,充电时的电极反应为放电时的逆反应,放电时电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.放电时,电子从负极沿导线流向正极,所以正极上聚集大量电子,根据异性相吸知,电解质溶液中阳离子向正极移动,故A正确;
B.原电池放电时,失电子发生氧化反应的电极是负极,该电池放电时氢气失电子发生氧化反应,所以通入氢气的电极是负极,故B错误;
C.根据电池反应式知,充电时H元素得电子发生还原反应,所以被还原,故C错误;
D.放电时,负极反应式为H2-2e-+2OH-=2H2O,氢氧根离子浓度降低,溶液的pH减小,故D错误;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极发生的反应是解本题关键,难点是电极反应式的书写,易错选项是A,注意电解质溶液中阴阳离子移动方向,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
1.下列有机反应中属于加成反应的是( )
| A. | CH2Cl2+Cl2$\stackrel{光照}{→}$CHCl3+HCl | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | 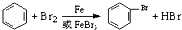 | |
| D. | 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O |
2.根据如图海水综合利用的工业流程图,判断下列说法正确的是( )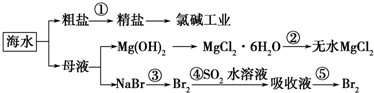

| A. | 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 | |
| D. | 从第③步到第⑤步的目的是为了浓缩 |
16.一定能在下列溶液中大量共存的离子组是( )
| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、I-、NO3- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |
13.下列化学用语表示正确的是( )
| A. | 氮原子结构示意图: | B. | 乙烯的结构式:CH2CH2 | ||
| C. | 含有10个中子的氧原子:${\;}_{10}^{18}$O | D. | 苯的结构简式: |
17.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,2.24L 苯中含有 0.6NA个碳原子 | |
| B. | 1 L PH=l的硫酸溶液中含有0.2NA个氢离子 | |
| C. | 1 L 1 mol•L-1的 FeC13溶液中,含有铁离子的数目为NA | |
| D. | t℃时,1 L pH=6的纯水中,含有10-6NA个OH- |
 如图所示:甲、乙为相互串联的两电解池.试回答:
如图所示:甲、乙为相互串联的两电解池.试回答: