题目内容
8.硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一.将0.100mol SO2(g)和0.060mol O2(g)放入容积为2L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040mol/L.①5分钟时O2的反应速率是0.004mol(L•min)-1;
②列式并计算该条件下反应的平衡常数K=1600.
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率减小(填“增大”、“减小”或“不变”).
④能判断该反应达到平衡状态的标志是BC.(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
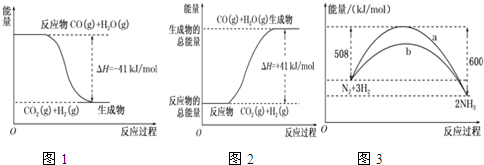
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示.平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).
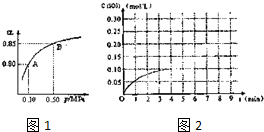
(3)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如图2所示.若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L).请在图中画出此变化过程中SO3浓度的变化曲线.
分析 (1)①根据v=$\frac{△c}{△t}$求得三氧化硫的速率,再根据速率之比等于计量数之比求得氧气的反应速率;
②依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
③K(300℃)>K(350℃),说明温度越高平衡常数越小,依据平衡移动原理分析,升温平衡向吸热反应方向进行;
④平衡标志是正逆反应速率相同,各成分含量保持不变;
(2)平衡常数随温度变化,温度不变,平衡常数不变;
(3)在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化,和平衡浓度画出变化图象.
解答 解:(1)①根据v=$\frac{△c}{△t}$可知,三氧化硫的速率为$\frac{0.040mol/L}{5min}$=0.008mol(L•min)-1,根据速率之比等于计量数之比可知,氧气的反应速率为$\frac{1}{2}$×0.008mol(L•min)-1=0.004mol(L•min)-1,
故答案为:0.004mol(L•min)-1;
②将0.100mol SO2(g)和0.060mol O2(g)放入容积为2L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L,2SO2(g)+O2(g)?2SO3
起始量(mol/L) 0.05 0.03 0
变化量(mol/L)0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数K=$\frac{0.0{4}^{2}}{0.01{\\;}^{2}×0.01}$=1600,
故答案为:1600;
③K(300℃)>K(350℃),说明温度越高平衡常数越小,反应逆向进行,即升温平衡逆向进行,二氧化硫转化率减小,故答案为:减小;
④2SO2(g)+O2(g)?2SO3(g),反应是气体体积变小的放热反应,
A.二氧化硫和三氧化硫起始量和变化量有关,SO2和SO3 浓度相等,不能说明反应达到平衡状态,故A错误;
B.因为反应前后总质量不变,总物质的量在变,所以容器中混合气体的平均分子量保持不变,说明反应达到平衡状态,故B正确;
C.反应前后压强不同,容器中气体的压强不变,说明反应达到平衡状态,故C正确;
D.SO3的生成速率与SO2的消耗速率相等,说明平衡正向进行,不能说明反应达到平衡状态,故D错误;
故答案为:BC;
(2)平衡常数只与温度有关,与压强无关,在温度不变的条件下,无论压强怎样变化,平衡常数都不变,故答案为:=;
(3)在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化和平衡浓度画出变化图象为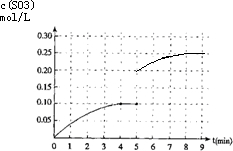 ,故答案为:
,故答案为: .
.
点评 本题考查了反应速率、化学平衡常数、平衡转化率、影响化学平衡的外界条件综合应用及知识迁移能力等考点,题目难度中等,注意平衡常数在计算中的应用,等效平衡的分析判断.

 名校课堂系列答案
名校课堂系列答案| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素. |
| B元素原子的核外p电子数比s电子数少1. |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满. |
| E元素的主族序数与周期数的差为4. |
| F是前四周期中电负性最小的元素. |
| G在周期表的第七列. |
 .
.(2)B的基态原子中能量最高的电子,其电子云在空间有3个伸展方向,原子轨道呈纺锤形.
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,价电子排布式为3d54s2.
(5)请写出元素D、E、F原子的最外层电子的成对电子数1、3、1.
| A. | 将固体熟石灰和氯化铵混合加热 | |
| B. | 加热试管中的氯化铵固体 | |
| C. | 将烧瓶中的浓氨水加热 | |
| D. | 将分液漏斗中的浓氨水滴入装有碱石灰的烧瓶中 |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa、25℃时,H2的燃烧热为△H=-285.8KJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3KJ |
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
| A. | pH=6的溶液 | B. | 能与金属Al反应放出H2的溶液 | ||
| C. | 遇酚酞显无色的溶液 | D. | c(H+)>c(OH-)的溶液 |
 .
.