题目内容
13.反应N2+3H2?2NH3刚开始时只通入N2和H2且N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,5min后测得NH3浓度为 1 mol•L-1,则此时间内,下列反应速率表示正确的是( )| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$计算v(NH3),再根据速率之比等于化学计量数之比计算v(N2)和v(H2).
解答 解:v(NH3)=$\frac{1mol•L{\;}^{-1}}{5min}$=0.2mol•L-1•min-1=12mol•L-1•s-1,
速率之比等于化学计量数之比,所以v(N2)=$\frac{1}{2}$v(NH3)=$\frac{1}{2}$×0.2mol•L-1•min-1=0.1mol•L-1•min-1,
v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×0.2mol•L-1•min-1=0.3mol•L-1•min-1,所以ABC错误,故D正确.
故选:D.
点评 本题主要考查化学反应速率的计算,难度较小,化学反应速率计算可用定义法,也可用化学计量数法,本题两种方法同时运用,根据情况选择合适的方法.

练习册系列答案
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
3.下列结论错误的是( )
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |
4.无色的气体甲,可能含NO、O2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成可能为( )
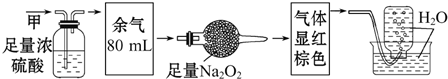

| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
1.以色列科学家达尼埃尔•谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖.某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体.下列分析合理的是( )
| A. | 烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为 6H++6e-=3H2↑ | |
| B. | 烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极 | |
| C. | 烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极 | |
| D. | 烧杯②中,固体最终完全溶解,溶液呈蓝色.向溶液中滴加KSCN溶液,溶液不变色 |
18.下列物质中含离子键的是( )
| A. | HCl | B. | NaF | C. | CH4 | D. | NH3 |
2.下列说法或解释不正确的是( )
| A. | 物质的量浓度均为1 mol•L-1的NaCl和MgCl2中:c(Cl-)=3c(Na+) | |
| B. | 等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积0.1 mol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
3.化学实验中,人的五官起着非常重要的作用,五官的使用符合实验要求的是( )
| A. |  鼻子闻 | B. |  嘴巴吹 | C. |  耳朵听 | D. |  眼睛看 |

 .
.