题目内容
19.下列方法中,不能用于实验室制取氨气的是( )| A. | 将固体熟石灰和氯化铵混合加热 | |
| B. | 加热试管中的氯化铵固体 | |
| C. | 将烧瓶中的浓氨水加热 | |
| D. | 将分液漏斗中的浓氨水滴入装有碱石灰的烧瓶中 |
分析 A.氯化铵与氢氧化钙加热生成氨气、氯化钙和水;
B.氯化铵受热分解生成氨气和氯化氢,氨气氯化氢遇冷又生成氯化铵;
C.浓氨水易挥发,加热促进浓氨水的挥发;
D.利用CaO与H2O剧烈反应,放出大量热,促进NH3.H2O的分解及NH3的挥发逸出.
解答 解:A.氯化铵与氢氧化钙加热生成氨气、氯化钙和水,方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,可以用来制备氨气,故A不选;
B.氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气,故B选;
C.浓氨水易挥发,加热促进浓氨水的挥发,可以用来制备氨气,故C不选;
D.CaO与H2O剧烈反应,放出大量热,促进NH3.H2O的分解及NH3的挥发逸出,可以制备氨气,故D不选;
故选:B.
点评 本题考查了制备氨气的实验方法和注意问题,掌握各种物质的性质是解题关键,题目较简单.

练习册系列答案
相关题目
9.下列说法中,正确的是( )
| A. | 中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铜丝搅拌棒测定出来的中和热值偏大 | |
| B. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol | |
| C. | 将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=-(2×57.3)KJ/mol |
10.一定条件下,充分燃烧一定量的丁烷(C4H10) 生成的二氧化碳气体和液态水,放出热量为Q kJ(Q>0),经测定完全吸收生成的二氧化碳需消耗5mol•L-1的KOH溶液100ml,恰好生成正盐,则此条件下反应丁烷燃烧热的△H为( )
| A. | +8QkJ/mol | B. | +16Q kJ/mol | C. | -8Q kJ/mol | D. | -16Q kJ/mol |
7.我们能在昏暗的光线下看见物体,离不开视网膜中一种叫“视黄醛”(见甲)的有机化合物,而与视黄醛相似结构的维生素A(见乙)常作为保健药物.则下列有关叙述正确的是( )


| A. | 视黄醛的分子式为C21H26O | |
| B. | 维生素A分子结构中含有苯环、碳碳双键和羟基 | |
| C. | 视黄醛是维生素A的氧化产物 | |
| D. | 1 mol甲和1 mol乙在一定条件下均最多能与6 mol H2发生反应 |
14.阿波罗号宇宙飞船上使用的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解质溶液为KOH溶液,反应保持在较高温度 ,使H2O蒸发,则下列叙述中正确的是( )
| A. | 此电池能发生蓝色火焰 | |
| B. | H2为正极,O2为负极 | |
| C. | 工作时,电解质溶液的pH不断减小 | |
| D. | 电极反应分别为负极:2H2+4 OH--4e-=4 H2O;正极:O2+2 H2O+4e-=4 OH- |
4.无色的气体甲,可能含NO、O2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成可能为( )
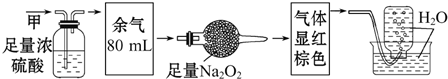

| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
11.下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是( )
| A. | CH3Cl | B. |  | ||
| C. |  | D. | 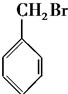 |
9.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |