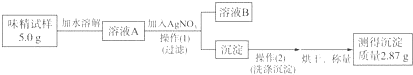
题目内容
14.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
分析 A、由图象分析,反应物的能量高于生成物的能量时,反应是放热反应;
B、旧键的断裂吸收能量,新键的生成释放能量;
C、旧键的断裂吸收能量;
D、根据图象可判断反应物与生成物的总能量大小关系.
解答 解:A、因反应物的能量高于生成物的能量时,所以反应是放热反应,故A错误;
B、旧键的断裂吸收能量,而不是释放能量,故B错误;
C、旧键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故C错误;
D、由图可知,1molA2和1molB2的总能量高于2molAB的总能量,故D正确;
故选D.
点评 本题考查学生有关化学反应中的能量变化知识,可以根据所学知识来进行,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.将5.6g铁粉投入盛有200mL 含0.1mol硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.25 mol•L-1•min-1 | D. | v(FeSO4)=0.25 mol•L-1•min-1 |
19.原电池产生电流的本质原因是( )
| A. | 原电池溶液中电解质能电离出自由移动的离子 | |
| B. | 有导线将两个活动性不同的电极连接 | |
| C. | 正极发生了氧化反应,负极发生了还原反应 | |
| D. | 电极上进行的氧化还原反应中有电子的转移 |
4.某恒温密闭容器中,可逆反应A(s)?B(?)+C(g)△H=+a kJ/mol达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内c(A)消耗﹕c(C)消耗=1﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a kJ |
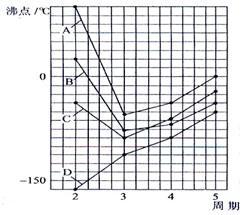 如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
 NH4+
NH4+
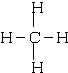 ; CO2O=C=O
; CO2O=C=O I.
I.