题目内容
10.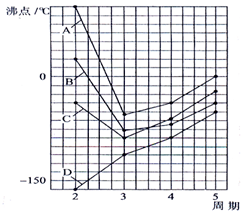 如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
分析 同一主族元素氢化物中,氢化物的沸点随着原子序数增大而呈增大趋势,但含有氢键的氢化物熔沸点最高;同一周期元素氢化物中,含有氢键的氢化物沸点较高,第二周期元素氢化物中水的沸点最高.
解答 解:同一主族元素氢化物中,氢化物的沸点随着原子序数增大而呈增大趋势,但含有氢键的氢化物熔沸点最高;同一周期元素氢化物中,含有氢键的氢化物沸点较高,第二周期元素氢化物中水的沸点最高,所以表示ⅥA族元素气态氢化物沸点的是A曲线;ⅣA族元素气态氢化物中都不含氢键,其沸点随着相对分子质量增大而增大,所以沸点的是曲线D;同一族中第3、4、5周期元素气态氢化物都不含氢键,氢化物的沸点与其分子间作用力有关,分子间作用力与相对分子质量成正比,所以同一族中第3、4、5周期元素气态氢化物的沸点随着相对分子质量增大而增大,则同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,所以曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O、HF、NH3、CH4,同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物;曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是第2周期元素的气态氢化物分子间存在氢键;
故答案为:H2O;HF;NH3;CH4;同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物;第二周期元素的氢化物分子间存在氢键.
点评 本题考查同主族元素的性质的递变规律,侧重于氢键的考查,为高考高频考点,难度不大,注意把握氢键的特点,把握相关知识的学习与积累.

练习册系列答案
相关题目
20.某烷烃的相对分子质量为86,分子中含有1个-CH2-、1个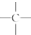 和若干个-CH3,则该烷烃的一氯代物有( )种.
和若干个-CH3,则该烷烃的一氯代物有( )种.
 和若干个-CH3,则该烷烃的一氯代物有( )种.
和若干个-CH3,则该烷烃的一氯代物有( )种.| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.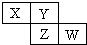 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
18.下列关于硫酸性质的描述中,正确的是( )
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 在受热的情况下浓硫酸也不与铁、铝发生反应 |
5.下列性质中,可以证明某化合物形成的晶体一定是离子晶体的是( )
| A. | 可溶于水 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
2.等质量的下列烃完全燃烧,消耗O2最多的是( )
| A. | C2H6 | B. | CH4 | C. | C2H4 | D. | C5H12 |
19.在一密闭容器内使0.4mol甲烷和适量氯气恰好完全发生取代反应,并生成相同量的四种有机取代物,当恢复到室温时,该容器内的气体的物质的量为(不考虑气体的溶解和液体的蒸发)( )
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
14.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
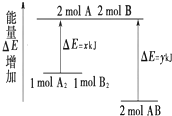

| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
 .
.