题目内容
2.将5.6g铁粉投入盛有200mL 含0.1mol硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.25 mol•L-1•min-1 | D. | v(FeSO4)=0.25 mol•L-1•min-1 |
分析 Fe为固体,浓度不变,不能利用浓度变化量表示反应速率,不能计算氢气浓度,也不能用氢气表示平均速率,根据方程式计算硫酸、硫酸铁的物质的量变化量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算2min内平均速率.
解答 解:5.6gFe的物质的量为$\frac{5.6g}{56g/mol}$=0.1mol,能与0.1mol硫酸恰好完全反应:
Fe+H2SO4 =Fe2SO4 +H2↑
0.1mol 0.1mol 0.1mol 0.1mol
A.Fe为固体,浓度不变,不能利用浓度变化量表示反应速率,故A错误;
B.硫酸浓度变化量为$\frac{0.1mol}{0.2L}$=0.5mol/L,故v(H2SO4)=$\frac{0.5mol/L}{2min}$=0.25 mol•L-1•min-1,故B错误;
C.不能计算氢气浓度,不能用氢气表示平均速率,故C错误;
D.硫酸亚铁的浓度变化量为$\frac{0.1mol}{0.2L}$=0.5mol/L,故v(FeSO4)=$\frac{0.5mol/L}{2min}$=0.25 mol•L-1•min-1,故D正确,
故选D.
点评 本题考查化学反应速率的有关计算,难度不大,注意对熟练公式的理解掌握,有利于基础知识的巩固.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
18.下列关于硫酸性质的描述中,正确的是( )
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 在受热的情况下浓硫酸也不与铁、铝发生反应 |
19.在一密闭容器内使0.4mol甲烷和适量氯气恰好完全发生取代反应,并生成相同量的四种有机取代物,当恢复到室温时,该容器内的气体的物质的量为(不考虑气体的溶解和液体的蒸发)( )
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
16.下列有关化学用语或名称,表达正确的是( )
| A. | 聚丙烯的结构简式为: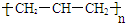 | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: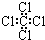 | D. | 乙烯的结构简式:CH2CH2 |
7.对于短周期元素,下列说法正确的是( )
| A. | 若两元素原子序数相差8,则周期数一定相差1 | |
| B. | 两种简单离子不可能相差3个电子层 | |
| C. | 同族的两元素之间不可能形成化合物 | |
| D. | 最外层电子数相同的微粒一定位于同一族 |
14.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
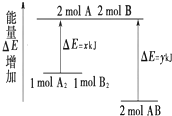

| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
11.已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,由此可知,由1mol Cl2和1mol H2生成2mol HCl的反应过程中( )
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
12.镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列气可作为冷却气的是( )
| A. | 空气 | B. | 氮气 | C. | 氩气 | D. | 二氧化碳 |