题目内容
4.某恒温密闭容器中,可逆反应A(s)?B(?)+C(g)△H=+a kJ/mol达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内c(A)消耗﹕c(C)消耗=1﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a kJ |
分析 A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗;
C、保持体积不变,若B为气态,则向平衡体系中加入B,平衡逆向移动;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q.
解答 解:A、若B是气体,平衡常数K=c(B)•c(C),若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,故A错误;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,但A为固体物浓度变化,故B错误;
C、保持体积不变,B可以是气体或是非气体,则向平衡体系中加入B,平衡可能向逆反应方向移动,故C正确;
D、反应焓变是指完全反应吸收的热量,因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于a,故D错误;
故选C.
点评 本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解设计解题关键,题目难度中等.

练习册系列答案
相关题目
14.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )


| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
15.三种主族非金属元素X、Y、Z在周期表中的位置如图所示,则下列说法中错误的是( )
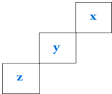

| A. | 元素Z一定是长周期元素,且既有金属性又有非金属性 | |
| B. | 三种元素中X元素的最高价氧化物对应的水化物酸性最强 | |
| C. | 三种元素中X元素的气态氢化物还原性最弱 | |
| D. | Y元素可形成多种不同的单质 |
12.镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列气可作为冷却气的是( )
| A. | 空气 | B. | 氮气 | C. | 氩气 | D. | 二氧化碳 |
19.如图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )


| A. | 1个乙分子中含有2个A原子 | B. | 摩尔质量关系为:2M (甲)=M (乙)+M (丙) | ||
| C. | 该反应一定属于氧化还原反应 | D. | 该反应类型是分解反应 |
9.下列图示的装置不属于原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
16.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是( )
| A. | 氧化钠和硫的熔化 | B. | 食盐和石蜡的熔化 | ||
| C. | 碘和干冰的升华 | D. | 氯化铵的分解和氯化钠溶解于水 |
14.X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素.下列说法不正确的是( )
| A. | 化合物YZ3极易溶解于水 | |
| B. | Z与M可以形成共价化合物 | |
| C. | 12g14X中含有质子的物质的量为6mol | |
| D. | 由上述四种元素组成的离子化合物受热易分解 |
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.