题目内容
19.原电池产生电流的本质原因是( )| A. | 原电池溶液中电解质能电离出自由移动的离子 | |
| B. | 有导线将两个活动性不同的电极连接 | |
| C. | 正极发生了氧化反应,负极发生了还原反应 | |
| D. | 电极上进行的氧化还原反应中有电子的转移 |
分析 原电池反应的本质为氧化还原反应,在反应中有电子的转移,在闭合电路中可形成电流,以此解答该题.
解答 解:原电池中,外电路中,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极;内电路中,电解质溶液中的阴离子向负极移动,阳离子向正极移动,所以形成了闭合回路,产生了电流,所以电极上进行的氧化还原反应中发生了电子的转移是原电池产生电流的本质原因,故选D.
点评 本题考查了原电池产生电流的本质原因,为高频考点,侧重于基本理论知识的综合理解和运用的考查,难度不大,注意只有在闭合回路中才可能产生电流.

练习册系列答案
相关题目
16.下列有关化学用语或名称,表达正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: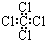 | D. | 乙烯的结构简式:CH2CH2 |
7.对于短周期元素,下列说法正确的是( )
| A. | 若两元素原子序数相差8,则周期数一定相差1 | |
| B. | 两种简单离子不可能相差3个电子层 | |
| C. | 同族的两元素之间不可能形成化合物 | |
| D. | 最外层电子数相同的微粒一定位于同一族 |
14.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )


| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
4.已知2H→H2并放出437.6kJ的热量,下列说法正确的是( )
| A. | 氢气分子内每个氢原子都达到8电稳定结构 | |
| B. | 氢气分子的能量比氢原子的能量低 | |
| C. | 1molH2离解成2molH 要放出437.6kJ 热量 | |
| D. | 氢原子的还原性比氢分子的还原性弱 |
11.已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,由此可知,由1mol Cl2和1mol H2生成2mol HCl的反应过程中( )
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
8.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.7×10-13.现有甲、乙两种溶液:甲溶液为1.0×10-2mol/L的AgNO3溶液,乙溶液为1.0×10-2mol/L的NaCl溶液和1.0×10-2mol/L 的NaBr的混合溶液.按以下两种步骤进行实验:①把少量甲溶液滴加到乙溶液中;②把少量乙溶液滴加到甲溶液中.下列说法正确的是( )
| A. | ①可能形成AgBr沉淀 | B. | ①一定能有效分离Cl-与Br- | ||
| C. | ②一定不能形成AgCl沉淀 | D. | ②一定能有效分离Cl-与Br- |
9.下列图示的装置不属于原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
 .
.