题目内容
3.味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na).谷氨酸钠有鲜味,易溶于水.某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”.某学校化学科研小组对此味精中NaCl的含量进行测定.
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定.
Ⅱ.设计实验方案:
(1)实验原理:通过味精与硝酸银反应生成氯化银的质量计算该味精中NaCl的质量分数.
(2)实验试剂:水、AgNO3溶液等
(3)实验过程:
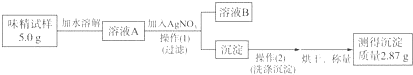
①操作(Ⅰ)所需要的玻璃仪器有烧杯、漏斗、玻璃棒.
②通过计算判断该味精中NaCl的质量分数是23.4%,判断该味精中NaCl不符合(填“符合”或“不符合”)其包装上标注的标准.
③若溶液A的体积为50mL,则其中NaCl的物质的量浓度为0.4 mol•L -1.
分析 ①依据溶液中分离出固体的实验操作是过滤,依据过滤实验装置分析需要的玻璃仪器;
②依据元素守恒计算氯化钠的含量和标准NaCl含量≤20%”比较分析判断;
③依据沉淀质量计算物质的量根据氯元素守恒得到氯化钠物质的量,依据c=$\frac{n}{V}$计算得到溶液浓.
解答 解:①溶液中分离出固体的实验操作是过滤,需要的玻璃仪器为普通漏斗 烧杯 玻璃棒;
故答案为:普通漏斗 烧杯 玻璃棒;
②流程分析,生成的氯化银沉淀质量2.87g,物质的量=$\frac{2.87g}{143.5g/mol}$=0.02mol,则样品中氯化钠物质的量为2mol,质量分数=$\frac{0.02mol×58.5g/mol}{5.0g}$×100%=23.4%>20%,所以味精中NaCl的质量分数不符合其包装上标注的标准;
故答案为:23.4%;不符合;
③依据上述计算可知A溶液中含有氯化钠物质的量为0.02mol,溶液A为50mL,则溶液A中NaCl的物质的量浓度=$\frac{0.02mol}{0.05L}$=0.4mol/L;
答:如果溶液A为50mL,则溶液A中NaCl的物质的量浓度是0.4mol/L.
点评 本题考查了物质组成的实验测定实验设计和计算应用,主要是实验基本操作的应用,掌握基础是解题关键,题目难度中等

练习册系列答案
相关题目
19.在一密闭容器内使0.4mol甲烷和适量氯气恰好完全发生取代反应,并生成相同量的四种有机取代物,当恢复到室温时,该容器内的气体的物质的量为(不考虑气体的溶解和液体的蒸发)( )
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
14.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )


| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1mol B-B 键放出xkJ能量 | |
| C. | 断裂2molA-B键需要吸收(y-x)kJ的能量 | |
| D. | 1molA2和1molB2的总能量高于2molAB的总能量 |
11.已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,由此可知,由1mol Cl2和1mol H2生成2mol HCl的反应过程中( )
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
18.已知2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.下列关于该反应的说法中正确的是( )
①该反应是一个放热反应
②参加反应的氢气和氧气的总能量高于反应生成的水的总能量
③该反应是一个吸热反应
④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
①该反应是一个放热反应
②参加反应的氢气和氧气的总能量高于反应生成的水的总能量
③该反应是一个吸热反应
④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
8.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.7×10-13.现有甲、乙两种溶液:甲溶液为1.0×10-2mol/L的AgNO3溶液,乙溶液为1.0×10-2mol/L的NaCl溶液和1.0×10-2mol/L 的NaBr的混合溶液.按以下两种步骤进行实验:①把少量甲溶液滴加到乙溶液中;②把少量乙溶液滴加到甲溶液中.下列说法正确的是( )
| A. | ①可能形成AgBr沉淀 | B. | ①一定能有效分离Cl-与Br- | ||
| C. | ②一定不能形成AgCl沉淀 | D. | ②一定能有效分离Cl-与Br- |
15.三种主族非金属元素X、Y、Z在周期表中的位置如图所示,则下列说法中错误的是( )
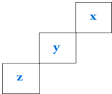

| A. | 元素Z一定是长周期元素,且既有金属性又有非金属性 | |
| B. | 三种元素中X元素的最高价氧化物对应的水化物酸性最强 | |
| C. | 三种元素中X元素的气态氢化物还原性最弱 | |
| D. | Y元素可形成多种不同的单质 |
12.镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列气可作为冷却气的是( )
| A. | 空气 | B. | 氮气 | C. | 氩气 | D. | 二氧化碳 |
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.