题目内容
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 常温下,0.1 mol•L-1醋酸钠溶液中含有Na+和CH3COO-的总数为0.2NA | |
| B. | 常温下,将0.1 mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA | |
| C. | 2 g NO2和44 g N2O4的混合气体中所含原子的总数为3NA | |
| D. | 0.1 mol甘油醛中含有双键的数目为0.3NA |
分析 A、溶液的体积不明确;
B、常温下,铁在浓硝酸中会钝化;
C、质量换算物质的量,结合分子式计算原子数;
D、甘油醛的结构简式为CH2(OH)CH(OH)CHO.
解答 解:A、溶液的体积不明确,故溶液中钠离子和醋酸根的个数和不能确定,故A错误;
B、常温下,铁在浓硝酸中会钝化,反应程度很小,故转移的电子数虽然无法计算,但肯定小于0.3NA个,故B错误;
C、2克NO2物质的量=$\frac{2g}{46g/mol}$;44克N2O4的物质的量=$\frac{44g}{92g/mol}$,混合气体所含原子数=$\frac{2g}{46g/mol}$×3+$\frac{44g}{92g/mol}$×6×NA=3NA.故C正确;
D、甘油醛的结构简式为CH2(OH)CH(OH)CHO,故1mol甘油醛中含1mol双键,故0.1mol甘油醛中含0.1mol双键,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
2.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
3.下列叙述不正确的是( )
| A. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| B. | 有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 | |
| C. | 人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 | |
| D. | 高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |
7.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热△H=-110.5 kJ•mol-1 |
17.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
4.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. | CH3-CH=CH-CHO | B. | CH3-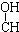 - -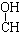 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-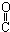 -CH2-CHO -CH2-CHO |
1.下列说法中正确的是( )
| A. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | S、C、Si都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,均能与碱反应而不能与酸反应 | |
| D. | 碱性氧化物都是由金属元素和氧元素组成,如K2O、CuO、Na2O、Na2O2、Mn2O7、Fe2O3等全部由金属元素和氧元素组成的,因此都为碱性氧化物 |
2.关于各组溶液中微粒浓度的关系正确的是( )
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
