题目内容
8.某探究小组在实验室中用铝土矿(主要成分为Al2O3,含有Fe2O3,SiO2)提取氧化铝,流程如图,回答下列问题:
(1)画出Al的原子结构示意图
 .
.(2)写出反应①中主要成分发生反应的离子方程式:Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O.
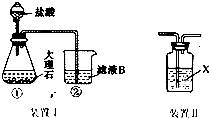
(3)实验室中,甲同学用如图装置 I制备CO2气体并通入滤液B中制备Al(OH)3,实验时结果没有产生预期现象.乙同学分析以为:甲同学通入的CO2气体中含有HCl气体是导致实验失败的原因,解决的方案是在装置 I中①和②之间增加Ⅱ.则装置Ⅱ中的试剂x应为饱和碳酸氢钠溶液.
(4)工业上通常以铝土矿提取得到的Al2O3为原料制备无水氯化铝:2Al2O3+6Cl2$\frac{\underline{\;\;△\;\;}}{\;}$4AlCl3+3CO2↑
该反应中的还原剂是C,制得22.4L(标准状况)CO2气体,有4mol电子发生转移.
分析 本题以铝土矿为原料制备氧化铝的工艺流程,涉及物质分离提纯的基本操作和铝及其化合物的性质;
(1)根据原子结构示意图的画法来解答;
(2)氧化铝是两性氧化物,既溶液强酸又溶于强碱.但Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅;
(3)在实验装置Ⅰ和装置Ⅱ之间增加除去CO2中含有HCl气体的装置,根据NaHCO3溶液能与HCl气体反应,而不与二氧化碳反应分析;
(4)Cl2有强氧化性,还原剂是有元素化合价降低的物质,根据碳元素化合价变化计算注意电子数目.
解答 解:(1)Al元素是第13号元素,核内由13个质子,核外有13个电子,Al元素的原子的最外层电子数是3,可以作出Al元素的原子结构示意图 ,故答案为:
,故答案为: ;
;
(2)①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.①氧化铝与盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl═2AlCl3+3H2O,对应的离子方程式为Al2O3+6H+═2Al3++3H2O
氧化铁与盐酸反应生成氯化铁与水,反应方程式为 Fe2O3+6HCl═2FeCl3+3H2O,对应离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O,Fe2O3+6H+═2Fe3++3H2O;
(3)在实验装置Ⅰ和装置Ⅱ之间增加除去CO2中含有HCl气体的装置,NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,在除去氯化氢的同时增加了二氧化碳的量,故答案为:饱和碳酸氢钠;
(4)2Al2O3+6Cl2+34AlCl3+3CO2↑反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,碳从0价变为+4价,是还原剂,若制得22.4L(标况下)CO2气体时,即1mol二氧化碳,转移电子为1mol×4=4mol,
故答案为:C;4.
点评 本题考查用铝土矿提取氧化铝,理解工艺流程是解题的关键,平时注意分析问题、解决问题的能力的培养,题目难度中等.

| A. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br- | |
| C. | Na2S溶液中 SO42-、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 NO3-、I-、Na+、Al3+ |
| A. | 液态HBr不导电,因此HBr是非电解质 | |
| B. | 自由移动离子数目多的电解质溶液导电能力不一定强 | |
| C. | CO2的水溶液能导电,因此CO2是电解质 | |
| D. | NaHSO4在水溶液及熔融状态下均可电离成Na+、H+、SO42- |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=144 | |
| C. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 | |
| D. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) |
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 200mL0.25mol•L-1AlCl3溶液 | ||
| C. | 50mL1mol•L-1NaCl溶液 | D. | 25mL0.5mol•L-1HCl溶液 |
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 8:53 |
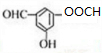
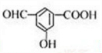
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
 .
.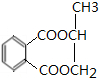 .
. .
. .
.