题目内容
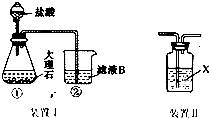
3.用霞石岩(化学式为 KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如图1:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤工序产生的滤液中含钠、钾和铝
的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中.部分物质的溶解度见图2.

试回答下列问题:
(1)灼烧得到固体M的化学方程式是2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(2)X物质是CO2,滤液W中主要含有的离子有Na+、K+、HCO3-.(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)碳酸化Ⅰ中发生主要反应的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(5)碳酸化Ⅱ调整pH=8的目的是碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
分析 霞石岩加石灰石和煤粉碎煅烧碳酸钙分解产生二氧化碳即X,再用水溶解,过滤除去在滤渣霞石泥中的钙和硅等其他杂质,所得溶液碳酸化调PH值到11使溶液中的铝离子沉淀,所以过滤出的沉淀是氢氧化铝,灼烧得到的固体M为氧化铝,滤液经过蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即得碳酸钠晶体,再将溶液碳酸化到PH值为8,所得溶液为碳酸氢钾,冷却,过滤,灼烧分解最终得到碳酸钾,
(1)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝;
(2)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-.
(3)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即可.
(4)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(5)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出;
解答 解:霞石岩加石灰石和煤粉碎煅烧碳酸钙分解产生二氧化碳即X,再用水溶解,过滤除去在滤渣霞石泥中的钙和硅等其他杂质,所得溶液碳酸化调PH值到11使溶液中的铝离子沉淀,所以过滤出的沉淀是氢氧化铝,灼烧得到的固体M为氧化铝,滤液经过蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即得碳酸钠晶体,再将溶液碳酸化到PH值为8,所得溶液为碳酸氢钾,冷却,过滤,灼烧分解最终得到碳酸钾,
(1)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(2)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,
故答案为:CO2;Na+、K+、HCO3-;
(3)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤;
(4)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(5)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,
故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
点评 该题是高考中的常见题型,难度大,综合性强,对学生的要求高.试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力.该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
| A. | a容器中,0~5min内平均反应速率ν(H2)=0.04mol/(L.min) | |
| B. | 反应均进行到5min时,三个容器中一定达到化学平衡状态的是b | |
| C. | 当三个容器内的反应都达到化学平衡时,CO转化率最大的是a | |
| D. | 保持温度和容积不变,若开始时向b容器中充入0.6mol CO(g)、1.2mol H2(g)和0.4mol CH3OH(g),则反应开始时ν正(H2)<ν(逆) |
| A. | 氯气能使润湿的淀粉碘化钾试纸变蓝 | |
| B. | 新制的氯水呈黄绿色是因为在溶液中溶有氯气分子 | |
| C. | 与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 | |
| D. | 氯水久置后,会使溶液酸性增强 |
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:4:3 | D. | 2:3:1 |



 .
.