题目内容
7.下列叙述中正确的是( )| A. | 液态HBr不导电,因此HBr是非电解质 | |
| B. | 自由移动离子数目多的电解质溶液导电能力不一定强 | |
| C. | CO2的水溶液能导电,因此CO2是电解质 | |
| D. | NaHSO4在水溶液及熔融状态下均可电离成Na+、H+、SO42- |
分析 A.电解质导电的条件是水溶液或熔融状态;
B.溶液的导电性与溶液离子的浓度有关,离子数目大的溶液,其导电性不一定强;
C.二氧化碳的水溶液中导电的离子不是二氧化碳自身电离的;
D.NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子.
解答 解:A.电解质导电的条件是水溶液或熔融状态,HCl在水溶液中电离出氢离子和氯离子,所以氯化氢属于电解质,故A错误;
B.离子浓度越大,溶液的导电性越强,自由移动离子数目多的电解质溶液,离子浓度不一定大,则溶液的导电能力不一定强,故B正确;
C.电解质自身能电离出自由移动离子,溶于水能导电的化合物,二氧化碳溶于水生成碳酸,碳酸能够电离使溶液导电,碳酸为电解质,而二氧化碳为非电解质,故C错误;
D.NaHSO4在水溶液中电离成Na+、H+、SO42-,而在熔融状态下电离产生Na+和HSO4-两种离子,故D错误;
故选B.
点评 本题考查了电解质与溶液导电性强弱的关系、电解质与非电解质的判断,题目难度不大,明确电解质、非电解质的概念及判断方法为解答关键,注意掌握影响溶液导电性的因素.

练习册系列答案
相关题目
18.自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式.火炬的可燃物是丁烷 (化学式为 C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见.下列关于丁烷的叙述不正确的是( )
| A. | 丁烷由碳、氢两种元素组成 | |
| B. | 丁烷由4个碳原子和10个氢原子构成 | |
| C. | 丁烷中碳、氢元素的质量比是24:5 | |
| D. | 丁烷分子由碳原子和氢原子构成 |
15.生活中处处有化学,下列叙述错误的是( )
| A. | 医用酒精的浓度通常为75% | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| D. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
1.苯甲酸广泛应用于制药和化工行业.某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下:
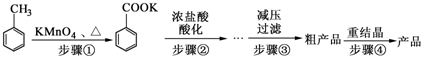
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
(1)将步骤①得到混合物加少量水,分离有机相和水相.有机相在上(填“上”或“下”)层;实验操作的名称是分液.
(2)步骤②用浓盐酸酸化的目的是使苯甲酸析出.
(3)减压过滤装置所包含的仪器除减压系统外,还有布氏漏斗、吸滤瓶(填仪器名称).
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是其它杂质也有可能析出.
(5)重结晶时需要趁热过滤,目的是为了减少苯甲酸的损失.

甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 | 易溶 | ||
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
(2)步骤②用浓盐酸酸化的目的是使苯甲酸析出.
(3)减压过滤装置所包含的仪器除减压系统外,还有布氏漏斗、吸滤瓶(填仪器名称).
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是其它杂质也有可能析出.
(5)重结晶时需要趁热过滤,目的是为了减少苯甲酸的损失.
6.标准状况下,将a L SO2和Cl2组成的混合气体通入100mL 0.1mol•L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅.向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65g.则下列关于该过程的推断不正确的是( )
| A. | 所得沉淀为0.05 mol的BaSO4 | B. | 混合气体中SO2的体积为0.448L | ||
| C. | a L混合气体的物质的量为0.04mol | D. | a的取值范围为0.672<a<0.896 |

 .
.