题目内容
20.下列溶液中,跟100mL0.5mol•L-1NaCl溶液中所含的Cl物质的量浓度相同的是( )| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 200mL0.25mol•L-1AlCl3溶液 | ||
| C. | 50mL1mol•L-1NaCl溶液 | D. | 25mL0.5mol•L-1HCl溶液 |
分析 100mL0.5mol/L NaCl溶液所含的Cl-的物质的量浓度0.5mol/L,根据溶液中溶质的浓度和溶质的构成进行计算,离子的物质的量浓度=溶质的物质的量浓度×一个溶质电离出离子的个数,与溶液的体积无关.
解答 解:100mL0.5mol•L-1NaCl溶液中Cl-物质的量浓度为0.5mol•L-1×1=0.5mol•L-1
A、100mL 0.5 mol•L-1MgCl2溶液中Cl-物质的量浓度为0.5mol•L-1×2=1mol•L-1L,故A错误;
B、200mL0.25mol•L-1AlCl3溶液中Cl-物质的量浓度为0.25mol•L-1×3=0.75mol•L-1,故B错误;
C、50mL1mol•L-1NaCl溶液中Cl-物质的量浓度为1mol•L-1×1=1mol•L-1,故C错误;
D、25mL0.5mol•L-1HCl溶液溶液中Cl-物质的量浓度为0.5mol•L-1×1=0.5mol•L-1,故D正确;
故选:D.
点评 本题考查离子浓度的计算,注意离子浓度与溶质浓度的关系即可解答,难度不大,注意与体积无关,掌握基础是关键.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
15.在一定条件下CO(g)和H2(g)发生反应:CO(g)+2H2(g)?CH3OH(g).在容积固定且均为1L的a、b、c三个密闭容器中分别充入1mol CO(g)和2mol H2(g),三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到5min时CH3OH(g)的浓度如图所示.下列说法正确的是( )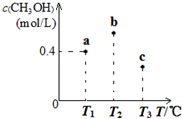

| A. | a容器中,0~5min内平均反应速率ν(H2)=0.04mol/(L.min) | |
| B. | 反应均进行到5min时,三个容器中一定达到化学平衡状态的是b | |
| C. | 当三个容器内的反应都达到化学平衡时,CO转化率最大的是a | |
| D. | 保持温度和容积不变,若开始时向b容器中充入0.6mol CO(g)、1.2mol H2(g)和0.4mol CH3OH(g),则反应开始时ν正(H2)<ν(逆) |
12.下列关于氯气或氯水的叙述不正确的是( )
| A. | 氯气能使润湿的淀粉碘化钾试纸变蓝 | |
| B. | 新制的氯水呈黄绿色是因为在溶液中溶有氯气分子 | |
| C. | 与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 | |
| D. | 氯水久置后,会使溶液酸性增强 |
9.在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol•L-1,现有该温度下的四份溶液:①pH=2的CH3COOH;②0.01mol•L-1的HCl;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 若将②与④按照10:1的体积比混合,混合溶液的pH<7 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① | |
| D. | 将四份溶液稀释相同倍数后,溶液的pH:④>③>①>② |

 .
.

 .反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
.反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.