��Ŀ����
13����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ��X��g��+Y��g��?2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±���| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A�� | ��Ӧǰ2 min��ƽ������v��Z��=2.0��10-3 mol/��L•min�� | |
| B�� | ���¶��´˷�Ӧ��ƽ�ⳣ��K=144 | |
| C�� | �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX������������� | |
| D�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv���棩��v������ |
���� A��ǰ2min��v��Y��=$\frac{\frac{0.16-0.10}{10}}{2}$mol/��L•min��=2.0��10-3 mol/��L•min����ͬһ���淴Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ��ݴ˼���v��Z����
B����Ӧ��7minʱ���÷�Ӧ�ﵽƽ��״̬�����ݷ���ʽ֪��ƽ��ʱc��X��=c��Y��=$\frac{0.10}{10}$mol/L=0.01mol/L��c��Z��=$\frac{0.16-0.10}{10}mol/L��2$=0.012mol/L����ѧƽ�ⳣ��K=$\frac{{c}^{2}��Z��}{c��X����c��Y��}$��
C��ͨ��0.2 mol Z����ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ���
D���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
��� �⣺A��ǰ2min��v��Y��=$\frac{\frac{0.16-0.10}{10}}{2}$mol/��L•min��=2.0��10-3 mol/��L•min����ͬһ���淴Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ���v��Z��=2v��X��=4.0��10-3 mol/��L•min������A����
B����Ӧ��7minʱ���÷�Ӧ�ﵽƽ��״̬�����ݷ���ʽ֪��ƽ��ʱc��X��=c��Y��=$\frac{0.10}{10}$mol/L=0.01mol/L��c��Z��=$\frac{0.16-0.10}{10}mol/L��2$=0.012mol/L����ѧƽ�ⳣ��K=$\frac{{c}^{2}��Z��}{c��X����c��Y��}$=$\frac{0.012��0.012}{0.01��0.01}$=1.44����B����
C��ͨ��0.2 mol Z����ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬ƽ�ⲻ�ƶ�����ƽ��ʱX������������䣬��C��ȷ��
D���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����Ӧ�ﵽ��ƽ��ǰv���棩��v����������D����
��ѡC��
���� ���⿼�黯ѧƽ���йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ƽ�ⳣ�����㡢��Ӧ���ʼ��㡢ƽ��Ӱ�����ص�֪ʶ�㣬�״�ѡ����C��ע�⣺�÷�Ӧǰ�����������֮�Ͳ��䵼��ѹǿ��Ӱ��ƽ���ƶ�����Ŀ�ѶȲ���

��֪��������ʵ��ܽ�ȣ�20��C��AgCl��1.5��10-4g Ag2SO4��0.796g
��1����ͬѧ��ʵ�����£�
| ��� | ���� | ���� |
| ʵ��� | ��2mL 1mol/L AgNO3��Һ���뵽 1mL 1mol/L FeSO4��Һ�� | ������ɫ����������к�ɫ������� |
| ȡ�ϲ���Һ���μ�KSCN��Һ | ��Һ��� |
�ٰ�ɫ�����Ļ�ѧʽ��Ag2SO4��
�ڼ�ͬѧ�ó�Ag+������Fe2+���������к�ɫ���壨Ag�����ɣ�����KSCN��Һ���죮
��2����ͬѧΪ̽��Ag+��Fe2+��Ӧ�ij̶ȣ�����ʵ���
a������ͼ����װ�ò�����ҩƷ�������е����ʲ����뷴Ӧ�������ֵ�ѹ��ָ��ƫ�ƣ�ƫ�Ƶķ��������������ʯī������������������һ��ʱ���ָ��ƫ�Ƽ�С��

b���������ձ�������ŨFe2��SO4��3��Һ�����ֵ�ѹ��ָ��ı仯����Ϊ��ƫ�Ƽ�С���ص���������ƫ�ƣ�
��a�м��ձ���ĵ缫��Ӧʽ��Fe2+-e-=Fe3+��
��b�е�ѹ��ָ������ƫ�ƺ���Ϊ�������������������
����ʵ��ó�Ag+��Fe2+��Ӧ�����ӷ���ʽ��Fe2++Ag+?Fe3++Ag��
��3��Ϊ��һ����֤��ͬѧ�Ľ��ۣ���ͬѧ�ֽ���������ʵ�飺
| ��� | ���� | ���� |
| ʵ��� | ��2mL 2mol/L Fe��NO3��3��Һ�������������Թ��� | ������ʧ |
| ʵ��� | ��2mL1mol/L Fe2��SO4��3��Һ�������������Թ��� | �������٣�δ��ʧ |
| ʵ��� | ��2mL 2mol/L FeCl3��Һ�������������Թ��� | ������ʧ |
���û�ѧ��Ӧԭ������ʵ������������������ͬ��ԭ����Һ�д���ƽ�⣺Fe3++Ag?Fe2++Ag+����AgCl��Ag2SO4�ܽ�ȸ�С��Cl-��SO42-�������ڽ���Ag+Ũ�ȣ�����ʵ�����ʵ���������еij̶ȸ���
| A�� | ҽ�þƾ���Ũ��ͨ��Ϊ75% | |
| B�� | ����Ĥ��һ����ʳƷ������Ҫ�ɷ��Ǿ�����ϩ | |
| C�� | ������������ͯʳƷ�ĸ�������ڰ�ȫ���� | |
| D�� | �����������˵Ľ������Σ�����������͡������ķ�ɢ��������ͬ |
�ױ���������ء�������IJ����������ʼ��±���
| ���� | �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | ��ˮ���ܽ��� |
| �ױ� | -95 | 110.6 | 0.8669 | ���� |
| ������� | 121.5��123.5 | ���� | ||
| ������ | 122.4 | 248 | 1.2659 | �� |
��2���������Ũ�����ữ��Ŀ����ʹ������������
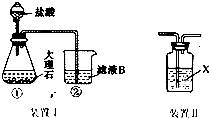
��3����ѹ����װ������������������ѹϵͳ�⣬���в���©��������ƿ�����������ƣ���
��4����֪�¶�Խ�ͱ�������ܽ��ԽС����Ϊ�˵õ�����ı����ᾧ�壬�ؽᾧʱ�����¶�Խ��Խ�ã���������������Ҳ�п���������
��5���ؽᾧʱ��Ҫ���ȹ��ˣ�Ŀ����Ϊ�˼��ٱ��������ʧ��
I����֪��Ӧ$\frac{1}{3}$Fe2O3��s��+CO��g��?$\frac{2}{3}$Fe��s��+CO2��g����H=-23.5kJ•mol-1���÷�Ӧ��1000���ƽ�ⳣ������4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol��Ӧ����l0min��ﵽƽ�⣮
��1��CO��ƽ��ת����=60%
��2�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ��d��
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ��ʹ����ƽ���������ֽӴ�
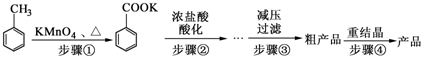
��¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO��g��+2H2��g��?CH3OH��g���������ͼʾ�ش��������⣺

��3���ӷ�Ӧ��ʼ��ƽ�⣬��H2Ũ�ȱ仯��ʾƽ����Ӧ����v��H2��=0.15mol/��L•min����
��4����֪������ȼ����286kJ/mol����д���״����岻���ȼ�յ��Ȼ�ѧ����ʽCH3OH��g��+O2��g��=2H2O��l��+CO��g����H=-481kJ/mol��
��5�������¶Ⱥ�������ͬ�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
A��c1=c2B.2Q1=Q3C.2��1=��3D����1+��2=1E���÷�Ӧ������1mol CH3OH����ų���Q1+Q2��kJ������
| A�� | ����0.4 mol FeBr2����Һ��ͨ��0.3 mol Cl2��ַ�Ӧ��4Fe2++2Br-+3Cl2�T4Fe3++6Cl-+Br2 | |
| B�� | ������������������Fe3O4+8H+�T2Fe3++Fe2++4H2O | |
| C�� | �����ڿ����еĵ��۵⻯����Һһ��ʱ�����Һ����ɫ��4H++4I-+O2�T2I2+2H2O | |
| D�� | ���������Һ�еμ�NaOH��Һ��NH4++OH-�TNH3��+H2O |

 ��
��