题目内容
19.如图所示,在较高温度时,钾、氧两元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )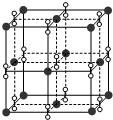
| A. | KO2 | B. | K2O2 | C. | K2O3 | D. | K2O |
分析 根据图知,黑色小球为单个离子,应该是钾离子,白色小球是过氧根离子,该晶胞中钾离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧根离子个数=1+12×$\frac{1}{4}$=4,所以钾离子和过氧根离子个数之比=4:4=1:1,据此判断化学式.
解答 解:根据图知,黑色小球为单个离子,应该是钾离子,白色小球是过氧根离子,该晶胞中钾离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,过氧根离子个数=1+12×$\frac{1}{4}$=4,所以钾离子和过氧根离子个数之比=4:4=1:1,其化学式为KO2,故选A.
点评 本题考查晶胞计算,侧重考查学生计算及空间想象能力,明确每个微粒被几个晶胞占有是解本题关键,利用均摊法解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
9.金属钛易于和肌肉长在一起,可用于制造各种人造关节,因此被称为“生物金属”.工业上由钛铁矿(主要成分为FeTiO3,含少量Fe2O3)制备钛的工艺流程如下:

(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C $\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;800℃-900℃\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 TiCl4+O2.已知相关数据如下:
结合上表数据,从反应进行的方向角度分析加入焦炭的必要性加入焦炭后发生反应①,与反应②相比,△H减小,△S增大,更有利于反应在较低温度下向右进行.
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.
(5)钛铁矿转化为粗TiO2也可以通过湿法完成:先用浓H2SO4溶解,将钛铁矿转化为TiO2+,然后使其水解得到粗TiO2.用酸清洗可除去粗TiO2中的Fe(OH)3杂质,已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下,Fe(OH)3(s)+3H+(aq)?Fe3+(aq)+3H2O(1)的平衡常数K=2.79×103.
(6)金属钛还可以通过电解直接获得.以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为TiO2+4e-=Ti+2O2-.

(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C $\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;800℃-900℃\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 TiCl4+O2.已知相关数据如下:
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.
(5)钛铁矿转化为粗TiO2也可以通过湿法完成:先用浓H2SO4溶解,将钛铁矿转化为TiO2+,然后使其水解得到粗TiO2.用酸清洗可除去粗TiO2中的Fe(OH)3杂质,已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下,Fe(OH)3(s)+3H+(aq)?Fe3+(aq)+3H2O(1)的平衡常数K=2.79×103.
(6)金属钛还可以通过电解直接获得.以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为TiO2+4e-=Ti+2O2-.
10.元素周期表的一部分,回答下列问题(用元素符号填写):
(1)分别写出①、③两种元素形成的高价态化合物的电子式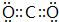
(2)写出⑨的原子结构示意图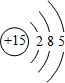 .
.
(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式为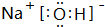 含有化学键为离子键、共价键
含有化学键为离子键、共价键
(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;形成两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到(11)的元素中,Cl原子半径最小.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
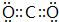
(2)写出⑨的原子结构示意图
 .
.(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式为
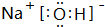 含有化学键为离子键、共价键
含有化学键为离子键、共价键(4)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;形成两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到(11)的元素中,Cl原子半径最小.
7.Y、Z三种金属,X、Y组成原电池,X是负极;把Z放入X的硝酸盐溶液中,Z表面有X析 出.三者的金属活动性顺序是( )
| A. | X>Y>Z | B. | Z>X>Y | C. | X>Z>Y | D. | Y>X>Z |
11.下列各组性质的比较,正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 酸性强弱:H2CO3<H2SiO3<HNO3 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 非金属性强弱:P>S>Cl |
8.某主族元素R的最高化合价与最低负化合价的代数和为2,下列叙述可能正确的是( )
| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
 ,取代反应
,取代反应 ,取代反应
,取代反应