题目内容
14.某温度下,纯水的[H+]=2×10-7mol/L,则此时溶液中[OH-]为2×10-7mol/L;若温度不变,滴入盐酸使[H+]=4×10-3mol/L,则此时溶液中[OH-]为10-11mol/L.分析 纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同,据此得出该纯水中氢氧根离子浓度;温度不变,水的离子积不变,计算出该温度下水的离子积,然后根据水的离子积表达式计算出滴入盐酸后溶液中的氢氧根离子浓度.
解答 解:某温度下纯水中的c(H+)=2×10-7mol/L,则此时溶液中的c(OH-)=c(H+)=2×10-7mol/L;
若温度不变,滴入稀盐酸,使c(H+)=4×10-3mol/L,溶液中则溶液中c(H+)•c(OH-)=2×10-7×2×10-7=4×10-14,
温度不变,则水的离子积不变,故c(OH-)=$\frac{4×1{0}^{-14}}{4×1{0}^{-3}}$mol/L=10-11mol/L,
故答案为:2×10-7;10-11.
点评 本题考查了物质的量浓度的计算、水的离子积的计算,题目难度中等,明确水的电离及其影响为解答关键,注意掌握水的离子积及其计算方法,明确物质的量浓度的概念及表达式.

练习册系列答案
相关题目
5.在下列各组物质中,属于同系物的一组是( )
| A. | 苯和苯酚 | B. | 甲烷和2,2-二甲基丁烷 | ||
| C. | 乙醇和乙二醇 | D. | 1,1-二氯乙烷和1,2-二氯乙烷 |
2.已知X、Y为同周期元素,且第一电离能X<Y,下列说法中正确的是( )
| A. | 电负性:X<Y | |
| B. | 周期表中,X可能在Y的右边 | |
| C. | 若X与Y形成化合物,则X显正价,Y显负价 | |
| D. | 气态氢化物的稳定性:HmY强于HnX |
9.元素A的阳离子与元素B的阴离子具有相同的电子层结构.以下关于A.B元素性质的比较中,不正确的是( )
| A. | 原子半径:A<B | |
| B. | 原子序数:A<B | |
| C. | 元素所在的周期数:A>B | |
| D. | A的最高正价与B的最低负价的绝对值一定相等 |
19.如图所示,在较高温度时,钾、氧两元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
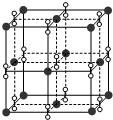

| A. | KO2 | B. | K2O2 | C. | K2O3 | D. | K2O |
6.下列数据是对应物质的熔点表,则有关判断正确的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1 291℃ | 190℃ | 2 073℃ | -107℃ | -57℃ | 1 723℃ |
| A. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| B. | 在共价化合物分子中各原子都形成8电子结构 | |
| C. | 金属晶体的熔点不一定比分子晶体的高 | |
| D. | 同族元素的氧化物不可能形成不同类型的晶体 |
3.下列化合物中既有离子键又有共价键的是( )
| A. | KBr | B. | N2 | C. | HBr | D. | NaOH |
4.下列关于乙烯的说法不正确的是( )
| A. | 分子中含有碳碳双键 | B. | 可作水果催熟剂 | ||
| C. | 分子式为C2H6 | D. | 能使溴水褪色 |

