题目内容
8.某主族元素R的最高化合价与最低负化合价的代数和为2,下列叙述可能正确的是( )| A. | R为第ⅣA族元素 | B. | R的气态氢化物为H2R | ||
| C. | R能形成含氧酸H2RO4 | D. | R气态氢化物水溶液呈碱性 |
分析 设主族元素R的最高正化合价为x,则最低负价x-8,故有x+(x-8)=2,解得x=+5,该元素处于ⅥA族,负价为-3价,据此解答.
解答 解:设主族元素R的最高正化合价为x,则最低负价x-8,故有x+(x-8)=2,解得x=+5,负价为-3价,
A.最高正化合价等于主族族序数,故该元素处于VA族,故A错误;
B.R的最低负化合价为-3,氢化物化学式为RH3,故B错误;
C.最高正化合价为+5价,含氧酸H2RO4中R的化合价为+6,故C错误;
D.若R为N元素,则气态氢化物NH3的水溶液呈碱性,故D正确,
故选D.
点评 本题考查原子结构与元素周期律,关键是清楚元素的最高价和最低负价的关系,难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
18.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,11.2LSO3所含的原子数为1.5NA | |
| B. | 常温常压下,1.8g H2O中含有的电子数为0.8NA | |
| C. | 常温常压下,48g O2和O3的混合物中含有的氧原子数为3NA | |
| D. | 标准状况下,0.1mol Cl2与足量NaOH溶液反应时,转移的电子数为0.2NA |
19.如图所示,在较高温度时,钾、氧两元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )


| A. | KO2 | B. | K2O2 | C. | K2O3 | D. | K2O |
16.下列物质的电子式书写正确的是( )
| A. |  | B. | 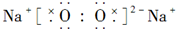 | ||
| C. | 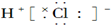 | D. | 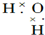 |
3.下列化合物中既有离子键又有共价键的是( )
| A. | KBr | B. | N2 | C. | HBr | D. | NaOH |
20.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响,实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验①的目的是研究温度对H2O2分解速率的影响,实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
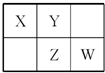 四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.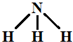 (写结构式);
(写结构式); ;
;