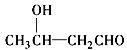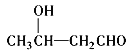题目内容
【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期 ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是_______(填元素符号),丁元素的最高正价为____价(填化合价)。
(3)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(4)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。
请分别写出上述反应的离子方程式:_____________;______________。
(5)丁单质通入冷的消石灰中可制得漂白粉,写出该反应的化学方程式:_____________________。
【答案】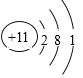 Al 16 三周期VIIA族 Na +7 > < Al (OH)3 + OH- = AlO
Al 16 三周期VIIA族 Na +7 > < Al (OH)3 + OH- = AlO![]() +2 H2O Al (OH)3 + 3H+= Al3++3 H2O 2 Cl2 + 2 Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2 H2O
+2 H2O Al (OH)3 + 3H+= Al3++3 H2O 2 Cl2 + 2 Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2 H2O
【解析】
甲的原子序数是11,应为Na元素;乙为第三周期ⅢA族元素,则乙为Al元素;丙的元素符号为S,则为硫元素,核电荷数是16;丁的原子结构示意图为![]() ,则为Cl元素,再结合元素周期律分析解题。
,则为Cl元素,再结合元素周期律分析解题。
由分析知:甲为Na元素、乙为Al元素、丙为S元素、丁为Cl元素;
(1①甲为Na元素,其原子结构示意图为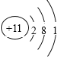 ;②为铝元素,元素符号为Al;③乙为硫元素,原子序数是16;④丁为氯元素,其在元素周期表中的位置是三周期VIIA族;
;②为铝元素,元素符号为Al;③乙为硫元素,原子序数是16;④丁为氯元素,其在元素周期表中的位置是三周期VIIA族;
(2)同周期主族元素,核电荷数越大,原子半径越小,则甲、乙、丙、丁四种元素中,原子半径最大的是Na;丁为氯元素,元素的最高正价为+7价;
(3)元素的金属性越强,其最高价氧化物对应水化物的碱性越强,Na比Al金属性强,则最高价氧化物对应水化物的碱性:甲>乙;氯元素的非金属性比硫元素强,HCl比H2S稳定,即简单气态氢化物的稳定性:丙<丁;
(4)Al(OH)3既能与强碱反应,又能与强酸反应,发生反应的离子方程式分别是;Al (OH)3+ OH-= AlO![]() +2 H2O、Al (OH)3+ 3H+= Al3++3 H2O;
+2 H2O、Al (OH)3+ 3H+= Al3++3 H2O;
(5)Cl2通入冷的消石灰中可制得漂白粉,发生反应的化学方程式为2 Cl2+ 2 Ca(OH)2= CaCl2+ Ca(ClO)2+ 2H2O。

【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理为H2SO4(浓)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
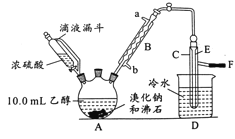
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中进水口为__口(填“a”或“b”)。
(2)实验中用滴液漏斗代替分液漏斗的优点为__。
(3)氢溴酸与浓硫酸混合加热发生氧化还原反应的化学方程式__。
(4)给A加热的目的是__,F接橡皮管导入稀NaOH溶液,其目的是吸收__和溴蒸气,防止__。
(5)C中的导管E的末端须在水面以下,其原因是__。
(6)将C中的镏出液转入锥形并瓶中,连振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,使溶液分层后用分液漏斗分去硫酸层;将经硫酸处理后的溴乙烷转入蒸镏烧瓶,水浴加热蒸馏,收集到35~40℃的馏分约10.0g。
①分液漏斗在使用前必须__;
②从乙醇的角度考虑,本实验所得溴乙烷的产率是__(精确到0.1%)。