题目内容
【题目】TPE(四苯基乙烯)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如下图,下列关于TPE的说法正确的是( )
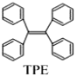
A.TPE的分子式为C26H22
B.TPE能发生加成反应,氧化反应,不能发生取代反应
C.TPE与化合物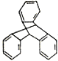 互为同分异构体
互为同分异构体
D.TPE的一氯代物有3种
【答案】D
【解析】
A.由TPE的结构可知,其分子式为C26H20,A项错误;
B.TPE的结构中含有碳碳双键和苯环,并且苯环上还有氢原子,所以TPE可以发生加成,氧化和取代反应,B项错误;
C. 的分子式为C20H14,TPE的分子式为C26H20,二者不互为同分异构体,C项错误;
的分子式为C20H14,TPE的分子式为C26H20,二者不互为同分异构体,C项错误;
D.由TPE的结构可知,TPE中有3种等效氢原子,所以一氯代物有3种,D项正确;
答案选D。

【题目】乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备。反应的化学方程式如下:![]() +CH3COOH
+CH3COOH![]()
![]() +H2O
+H2O
某实验小组分别采用以下两种方案合成乙酰苯胺:
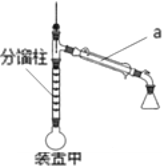
方案甲:采用装置甲:在圆底烧瓶中加入5.0mL苯胺、7.4mL乙酸,加热至沸,控制温度计读数100~105℃,保持液体平缓流出,反应40 min后停止加热即可制得产品。
方案乙:采用装置乙:加热回流,反应40 min后停止加热。其余与方案甲相同。
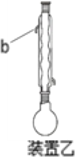
已知:有关化合物的物理性质见下表:
化合物 | 密度(g·cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
乙酸 | 1.05 | 易溶于水,乙醇 | 17 | 118 |
苯胺 | 1.02 | 微溶于水,易溶于乙醇 | –6 | 184 |
乙酰苯胺 | — | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
请回答:
(1)仪器a的名称是_________
(2)分别从装置甲和乙的圆底烧瓶中获得粗产品的后续操作是____________
(3)装置甲中分馏柱的作用是______________
(4)下列说法正确的是__________
A.从投料量分析,为提高乙酰苯胺产率,甲乙两种方案均采取的措施是乙酸过量
B.实验结果是方案甲的产率比方案乙的产率高
C.装置乙中b处水流方向是出水口
D.装置甲中控制温度计读数在118℃以上,反应效果会更好
(5)甲乙两方案获得的粗产品均采用重结晶方法提纯。操作如下:
①请选择合适的编号,按正确的操作顺序完成实验(步骤可重复或不使用)
____→____→____→____→过滤→洗涤→干燥
a冷却结晶 b加冷水溶解 c趁热过滤 d活性炭脱色 e加热水溶解
上述步骤中为达到趁热过滤的目的,可采取的合理做法是___________
②趁热过滤后,滤液冷却结晶。一般情况下,有利于得到较大的晶体的因素有_____
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
③关于提纯过程中的洗涤,下列洗涤剂中最合适的是_____________。
A.蒸馏水 B.乙醇 C.5%Na2CO3溶液 D.饱和NaCl溶液
【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期 ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是_______(填元素符号),丁元素的最高正价为____价(填化合价)。
(3)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(4)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。
请分别写出上述反应的离子方程式:_____________;______________。
(5)丁单质通入冷的消石灰中可制得漂白粉,写出该反应的化学方程式:_____________________。
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。NaBH4中存在__(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__,其中Be的配位数为__。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:___。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=__g·cm-3(列出计算表达式)。