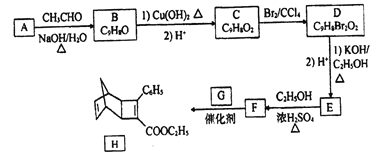
题目内容
【题目】己知断裂1molH2(g)中的H—H键需吸收436kJ 能量,断裂1molO2中的共价键需吸收496kJ能量,且氢气在氧气中燃烧的能量变化如图所示。下列说法正确的是
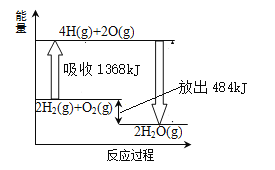
A.H2O(g)=H2(g)+1/2O2(l) △H=+242kJ/mol
B.H2(g)+1/2O2(g)= H2O(l) △H<-242kJ/mol
C.形成1molH2O(g)中的化学键需吸收926kJ
D.2H2(g)+ O2 (g)= 2H2O (g) △H=-1852kJ/mol
【答案】B
【解析】
A.根据示意图可知1mol气态水分解生成氢气(气态)和氧气(气态)吸收242kJ热量,而选项中给定的是O2(l),所以吸收的热量不等于242kJ,A错误;
B.气态水的能量高于液态水的能量,所以生成液态水放热多,则H2(g)+1/2O2 (g)=H2O (l)△H<-242kJ/mol,B正确;
C.反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则断裂1molH2O(g)中的化学键需吸收![]() =926kJ,C错误;
=926kJ,C错误;
D.根据示意图可知2H2(g)+O2(g)=2H2O (g) △H=-484kJ/mol,D错误;
答案选B。

【题目】大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式,下表列举了不同温度下大气固氮和工业固氮的部分K值:
N2+O2 | N2+3H2 | |||
温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
K | 3.84×10-31 | 0.1 | 5×108 | 1.88×104 |
下列说法正确的是
A.在常温下,工业固氮非常容易进行
B.人类可以通过大规模模拟大气固氮利用氮资源
C.大气固氮与工业固氮的K值受温度和压强等的影响较大
D.大气固氮是吸热反应,工业固氮是放热反应
【题目】乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备。反应的化学方程式如下:![]() +CH3COOH
+CH3COOH![]()
![]() +H2O
+H2O
某实验小组分别采用以下两种方案合成乙酰苯胺:
方案甲:采用装置甲:在圆底烧瓶中加入5.0mL苯胺、7.4mL乙酸,加热至沸,控制温度计读数100~105℃,保持液体平缓流出,反应40 min后停止加热即可制得产品。
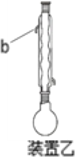
方案乙:采用装置乙:加热回流,反应40 min后停止加热。其余与方案甲相同。
已知:有关化合物的物理性质见下表:
化合物 | 密度(g·cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
乙酸 | 1.05 | 易溶于水,乙醇 | 17 | 118 |
苯胺 | 1.02 | 微溶于水,易溶于乙醇 | –6 | 184 |
乙酰苯胺 | — | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
请回答:
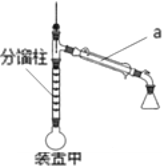
(1)仪器a的名称是_________
(2)分别从装置甲和乙的圆底烧瓶中获得粗产品的后续操作是____________
(3)装置甲中分馏柱的作用是______________
(4)下列说法正确的是__________
A.从投料量分析,为提高乙酰苯胺产率,甲乙两种方案均采取的措施是乙酸过量
B.实验结果是方案甲的产率比方案乙的产率高
C.装置乙中b处水流方向是出水口
D.装置甲中控制温度计读数在118℃以上,反应效果会更好
(5)甲乙两方案获得的粗产品均采用重结晶方法提纯。操作如下:
①请选择合适的编号,按正确的操作顺序完成实验(步骤可重复或不使用)
____→____→____→____→过滤→洗涤→干燥
a冷却结晶 b加冷水溶解 c趁热过滤 d活性炭脱色 e加热水溶解
上述步骤中为达到趁热过滤的目的,可采取的合理做法是___________
②趁热过滤后,滤液冷却结晶。一般情况下,有利于得到较大的晶体的因素有_____
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
③关于提纯过程中的洗涤,下列洗涤剂中最合适的是_____________。
A.蒸馏水 B.乙醇 C.5%Na2CO3溶液 D.饱和NaCl溶液
【题目】现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B. c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中的 c(H+)/c(CH3COOH) 比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)______(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 | K1=1.54×10-2 K2=1.02×10-7 |
①下列微粒可以大量共存的是______![]() 填字母
填字母![]() 。
。
a.CO32-、HSO3- b.HCO3-、HSO3-
c.SO32-、HCO3- d.CO32- 、H2CO3
②写出下列反应的离子方程式:
H2SO3+Na2CO3(少量):_______________
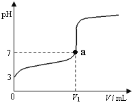
室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
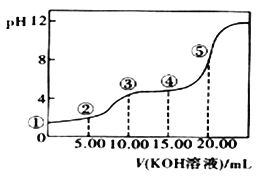
(5)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=_____mol/L。点⑤所示的溶液中各离子浓度的大小顺序_____.
(6)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于锥形瓶中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是_______;该过程中发生反应的离子方程式为________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为________。
【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期 ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是_______(填元素符号),丁元素的最高正价为____价(填化合价)。
(3)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(4)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。
请分别写出上述反应的离子方程式:_____________;______________。
(5)丁单质通入冷的消石灰中可制得漂白粉,写出该反应的化学方程式:_____________________。