题目内容
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
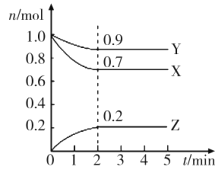
根据图中数据填空:
(1)该反应的化学方程式为___。
(2)若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为___。
(3)若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___ (填“增大”“减小”或“相等”)。
【答案】3X+Y![]() 2Z 9:10 增大
2Z 9:10 增大
【解析】
(1)根据图像,X和Y的物质的量减少,X和Y为反应物,Z的物质的量增多,Z为生成物;2min后各组分的物质的量保持不变,达到了该条件下的最大限度,故该反应为可逆反应;利用物质的量变化之比等于化学计量数之比,X、Y、Z的物质的量变化比值为(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,该反应的化学方程式为3X+Y![]() 2Z;
2Z;
(2)根据阿伏加德罗定律PV=nRT可知,恒温恒容时,压强之比等于物质的量之比,开始时组分的总物质的量为(1.0mol+1.0mol)=2.0mol,达到平衡时,组分的总物质的量为(0.9mol+0.7mol+0.2mol)=1.8mol,反应达到平衡时的压强与起始压强之比为1.8:2.0=9:10;
(3)混合气体的平均摩尔质量为M=![]() ,组分都是气体,气体总质量不变,总物质的量减少,则混合气体的平均摩尔质量增大,即混合气体的平均相对分子质量比起始投料时增大。
,组分都是气体,气体总质量不变,总物质的量减少,则混合气体的平均摩尔质量增大,即混合气体的平均相对分子质量比起始投料时增大。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式,下表列举了不同温度下大气固氮和工业固氮的部分K值:
N2+O2 | N2+3H2 | |||
温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
K | 3.84×10-31 | 0.1 | 5×108 | 1.88×104 |
下列说法正确的是
A.在常温下,工业固氮非常容易进行
B.人类可以通过大规模模拟大气固氮利用氮资源
C.大气固氮与工业固氮的K值受温度和压强等的影响较大
D.大气固氮是吸热反应,工业固氮是放热反应
【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期 ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是_______(填元素符号),丁元素的最高正价为____价(填化合价)。
(3)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(4)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。
请分别写出上述反应的离子方程式:_____________;______________。
(5)丁单质通入冷的消石灰中可制得漂白粉,写出该反应的化学方程式:_____________________。