题目内容
12.如表是元素周期表的一部分,针对表中的①~⑩中元素,用化学用语回答以下问题:| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
(2)①⑦⑧元素的最高价氧化物对应的水化物中碱性由强到弱的顺序为KOH>NaOH>LiOH,
(3)④与⑥两元素的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
(4)用电子式表示③和⑦元素形成化合物的过程
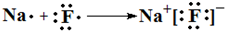 ,
,(5)②与⑨元素氢化物的稳定性相比较,较弱的是H2Se.
分析 由元素在周期表中的位置可知,①为Li,②为O,③为F,④为Al,⑤为Si,⑥为Cl,⑦为Na,⑧为K,⑨为Se,⑩为Br.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强;
(3)④与⑥两元素的最高价氧化物对应的水化物分别为Al(OH)3、HClO4,二者该反应生成盐与水;
(4)③和⑦元素形成化合物为NaF,由钠离子与氟离子构成;
(5)元素非金属性越强,对应氢化物越稳定.
解答 解:由元素在周期表中的位置可知,①为Li,②为O,③为F,④为Al,⑤为Si,⑥为Cl,⑦为Na,⑧为K,⑨为Se,⑩为Br.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述元素中K原子半径最大,故答案为:K;
(2)同主族自上而下金属性增强,元素的金属性越强,其最高价氧化物的水化物碱性越强,故碱性:KOH>NaOH>LiOH,故答案为:KOH>NaOH>LiOH;
(3)④与⑥两元素的最高价氧化物对应的水化物分别为Al(OH)3、HClO4,二者该反应生成盐与水,反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)③和⑦元素形成化合物为NaF,由钠离子与氟离子构成,用电子式表示形成过程为: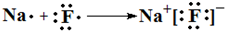 ,故答案为:
,故答案为: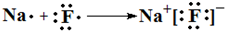 ;
;
(5)同主族自上而下非金属性减弱,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:H2O>H2Se,故答案为:H2Se.
点评 本题考查位置结构性质关系的应用,需要学生熟悉元素在周期表结构,注意对元素周期律的理解应用.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
2.下列物质的分子中,所有的原子都在同一平面上的是( )
| A. | NH3 | B. | 乙烯 | C. | 甲烷 | D. | 丙烯 |
3.一定温度下,向饱和的烧碱溶液中加入一定量的Na2O2,充分反应后,恢复到原来的温度,下列说法中正确的是( )
| A. | 溶液中pH值不变,有H2放出 | B. | 液液中Na+数目减少,有O2放出 | ||
| C. | 溶液中pH值增大,有O2放出 | D. | 溶液中Na+浓度增大,有O2放出 |
20.等温等容条件下有反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡.Ⅰ:A、B的起始浓度均为2mol/L;Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成相同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的vA等于Ⅱ途径的vA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |
7.下列离子方程式书写正确的是( )
| A. | Cu(OH)2浊液中滴加醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | NaOH溶液中加入铝片:2Al+2 OHˉ═2AlO2ˉ+3H2↑ | |
| C. | 已知Fe2+可以还原C12、Br2,C12可以氧化Br-生成Br2,在标准状况下,向10mL 0.1moL/LFeBr2溶液中通入22.4mL氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| D. | NaHCO3溶液与稀硫酸溶液的反应:HCO3-+H+═H2O+CO2↑ |
17.某种药物合成中间体的结构简式为: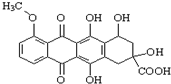 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 该化合物属于芳香族化合物,分子式为C20H16O9 | |
| B. | 能发生消去反应、酯化反应、取代反应、氧化反应、水解反应等 | |
| C. | 能分别与金属Na、NaHCO3溶液反应 | |
| D. | 1 mol该有机物与足量NaOH溶液反应,消耗3 mol NaOH |
4.下列说法正确的是( )
| A. | C4H10和C20H42 互为同系物 | B. | 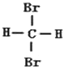 和 和 互为同分异构体 | ||
| C. | 12C和14C互为同素异形体 | D. | H2、D2和T2互为同位素 |
1.对氯气的漂白性的探究,学习小组进行了如下实验,请将表格填写完整
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
2.乙炔分子中有3个σ键、两个π键,它们分别是( )
| A. | C-H之间是sp形成的σ键,C-C之间全是未参加杂化的2p轨道形成的π键 | |
| B. | C-C之间是sp形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相平行 | |
| D. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相垂直 |