题目内容
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaC1O;氯气与热的氢氧化钠溶液反应可生成NaC1O和NaC1O3。②在酸性较弱时KI只能被NaC1O氧化,在酸性较强时亦能被NaC1O3氧化。
(1)该小组利用如图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳极”或“阴极”)。生成NaClO的离子方程式为 。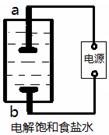
(2)该小组将0.784 L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
①取稀释后的溶液25.00 mL用醋酸酸化,加入过量KI溶液。用0.2000 mol·L-1 Na2S2O3溶液滴定:I2+2S2O32-=2I-+S4O62-,消耗Na2S2O3溶液10.00 mL时恰好到达终点。
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作②中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③计算氢氧化钠溶液的物质的量浓度。
(1)阴极 C12+OH-=C1-+C1O-+H2O
(2)①ClO3-+6I-+6H+=3I2+Cl-+3H2O
②n(NaClO)︰n(NaClO3)=1︰1
③Cl2 ~ 2NaOH
1 2
0.784 L÷22.4 L·mol-1 c(NaOH)×50 mL×10-3
c(NaOH)×50 mL×10-3="2×0.784" L÷22.4 L·mol-1
c(NaOH) =" 1.4" mol·L-1
解析试题分析: (1)电解饱和食盐水生成氢氧化钠、氯气和氢气,氯气与氢氧化钠生成氯化钠、次氯酸钠和水。氯气从b电极产生与氢氧化钠溶液反应,a电极为阴极。(2)①ClO3-氧化I-生成Cl-和I2,根据得失电子相等、电荷守恒、质量守恒配平。②ClO-与I-以物质的量比1:2反应生成Cl-和I2,ClO-~2S2O32-;ClO3-与I-以物质的量比1:6反应,ClO3-~6S2O32-,由硫代硫酸钠溶液体积可知ClO-和ClO3-物质的量比为1:1。③氯气与氢氧化钠生成NaCl、NaClO、NaClO3和水,观察生成物可知Na与Cl物质的量比为1:1,0.035molCl2中Cl为0.07mol,所以NaOH物质的量为0.07mol,物质的量浓度为1.4mol/L。
考点: 电化学 离子方程式的书写 化学计算

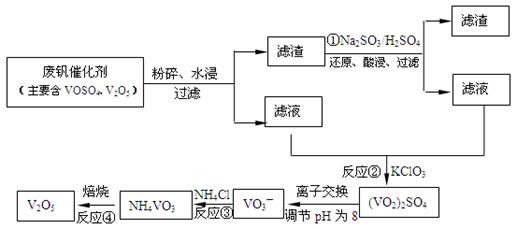
实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用FeC13溶液吸收多余的SO2气体。
(1)写出SO2与FeC13溶液反应的离子方程式: 。
(2)FeC13溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有:H+、Fe2+、C1—、SO42-。某同学认为还可能存在其他离子,并提出假设进行实验探究。
①提出合理假设:
假设1:还存在HSO3-、SO32-
假设2:还存在Fe3+
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 溶液。 | 现象: 结论:假设1不成立。 |
| 步骤2: | 现象: 结论:假设2成立。 |
(3)测定空气中SO2含量的方法是:把500L含SO2气体的空气通入20mL含0.00015molKMnO4的溶液中,充分反应后,再用0.02000mol/L的KI溶液滴定过量的KMnO4,消耗KI 溶液25.00mL,则空气中的SO2含量为 mg/L。
(5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,10I—+2MnO4-+16H+=2Mn2++5I2+8H2O)
下列是氧化还原反应也是吸热反应的是( )
| A.灼热的炭与二氧化碳反应 | B.铁和稀硫酸的反应 |
| C.氢氧化钡晶体的粉末和氯化铵晶体混合 | D.钢铁制品生锈的反应 |
4.6g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到4480mLNO2和336 mLN2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是46:69 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1 |
| C.产生沉淀8.51 g |
| D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
下列反应既是氧化还原反应,又是吸热反应的是
| A.锌粒与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的碳与CO2反应 | D.葡萄糖在人体内氧化 |

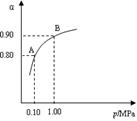
 2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。