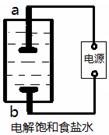
题目内容
下列反应既是氧化还原反应,又是吸热反应的是
| A.锌粒与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的碳与CO2反应 | D.葡萄糖在人体内氧化 |
C
解析试题分析:有元素化合价变化的反应为氧化还原反应;常见的吸热反应有Ba(OH)2?8H2O与NH4Cl反应、C参加的氧化还原反应、大多数的分解反应等,则A、锌粒与稀H2SO4反应,有化合价的变化属于氧化还原反应,但属于放热反应,故A不选;B、Ba(OH)2?8H2O与NH4Cl反应为吸热反应,但不属于氧化还原反应,故B不选;C、灼热的炭与CO2反应,有化合价的变化属于氧化还原反应,且属于吸热反应,故C选;D、葡萄糖在人体内氧化,有化合价的变化属于氧化还原反应,但属于放热反应,故D不选;故选:C。
考点:考查氧化还原反应及吸热反应判断

 春雨教育同步作文系列答案
春雨教育同步作文系列答案已知在热的碱性溶液中,NaClO能发生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,则其最终产物是
| A.NaCl、NaClO | B.NaCl、NaClO3 | C.NaClO、NaClO3 | D.NaClO2、NaClO4 |
下面有关氧化还原反应的叙述不正确的是 ( )
| A.氧化还原反应的本质是电子的转移 |
| B.在氧化还原反应中,失去电子的物质,一定有元素化合价升高 |
| C.肯定有一种元素被氧化,另一种元素被还原 |
| D.在反应中不一定所有元素的化合价都发生变化 |
在炼铜的过程中发生:Cu2S + 2Cu2O =" 6Cu" + SO2↑,则下列叙述正确的是
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法中每生成1mol Na2FeO4共转移4mol电子 |
| C.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 |
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
| A.KCl中含有35Cl |
| B.生成物Cl2的相对分子质量为73.3 |
| C.该反应转移的电子数为6e- |
| D.氧化剂和还原剂的物质的量之比为1:6 |
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO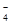 >Cl2>Fe3+ >I2 >Cl2>Fe3+ >I2 |
| B.FeCl3既有氧化性又有还原性 |
| C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3 |
| D.FeCl3能使湿润的淀粉碘化钾试纸变蓝 |
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是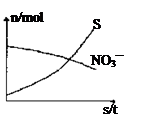
| A.配平后氧化剂与还原剂的化学计量数之比为1:4 |
| B.硫元素在反应中被还原 |
| C.还原剂是含NH4+的物质 |
| D.若生成1molNH4+,则转移电子2mol。 |