题目内容
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称)
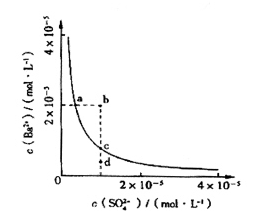
(2)催化氧化阶段反应2SO2(g)+O2(g)  2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。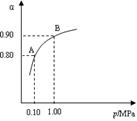
理论上要提高SO2的转化率,反应的条件应是 温 、高压(填“高”、“低”、或“常” ),但通常情况下工业生产中采用常压的原因是 。
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。该反应的平衡常数等于 。
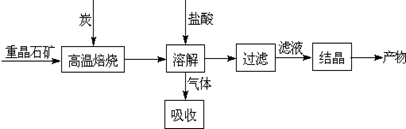
(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。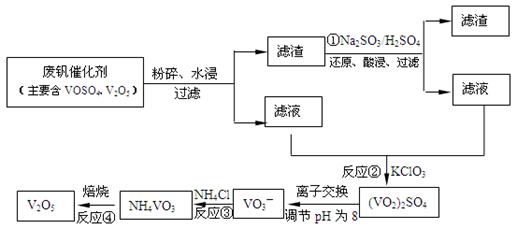
则:反应①②③④中属于氧化还原反应的是 (填数字序号),反应③的离子方程式为 。该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。 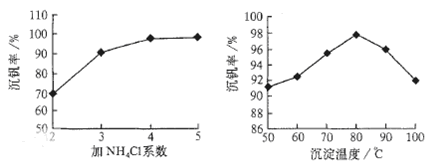
(1)接触室 (2)低 使用常压SO2就可以达到较高的转化率。 (3) 400mol2/L2 .
(4)①② NH4+ + VO3-==NH4VO3↓ 4和80℃。
解析试题分析:(1)煅烧黄铁矿形成的炉气是在接触室中进行催化氧化实验的。在SO2氧化的过程中杂质有些可能是少量的也会引起催化剂中毒,所以必须经除尘、洗涤、干燥后进入接触室。(2)由于反应2SO2(g) +O2(g)  2SO3(g);△H<0的正反应为放热反应。所以为了提高原料的利用率,反应应该在低温下进行。该反应的正反应为气体体积减小的反应。增大压强能使平衡正向移动,反应物的转化率提高,但是由于增大压强对设备需要承受压强的要求提高,需要的动力也增大,这就需要增大投入,但是制取的物质收益甚微,相对来说,不划算。而且在使用常压SO2就可以达到较高的转化率。在反应开始时c (SO2)=0.4mol/L;c(O2)=0.2mol/L。由于反应达平衡后,体系总压强为0.10 M Pa,此时SO2的平衡转化率为0.8.则平衡时c (SO2)=0.08mol/L;c(O2)=0.04mol/L;c (SO3)=0.32mol/L;因此该反应的化学平衡常数K=
2SO3(g);△H<0的正反应为放热反应。所以为了提高原料的利用率,反应应该在低温下进行。该反应的正反应为气体体积减小的反应。增大压强能使平衡正向移动,反应物的转化率提高,但是由于增大压强对设备需要承受压强的要求提高,需要的动力也增大,这就需要增大投入,但是制取的物质收益甚微,相对来说,不划算。而且在使用常压SO2就可以达到较高的转化率。在反应开始时c (SO2)=0.4mol/L;c(O2)=0.2mol/L。由于反应达平衡后,体系总压强为0.10 M Pa,此时SO2的平衡转化率为0.8.则平衡时c (SO2)=0.08mol/L;c(O2)=0.04mol/L;c (SO3)=0.32mol/L;因此该反应的化学平衡常数K= (3)在废钒催化剂中主要含VOSO4、V2O5,经过粉碎、水浸、过滤得到的滤渣中含有V2O5。向其中加入Na2SO3、H2SO4,经过氧化还原反应,V2O5变为可溶于水的VOSO4,留在滤液中。向滤液中加入KClO3,发生氧化反应反应,得到(VO2)2SO4。在(VO2)2SO4、VO3—、NH4VO3及V2O5中V的化合价都是+5价,化合价不变,所以是非氧化还原反应。因此反应①②③④中属于氧化还原反应的是①② 其中反应③的离子方程式为NH4+ + VO3-=NH4VO3↓ 。根据题目提供的图像可知:控制氯化铵系数是4;温度为80℃ 。这时沉钒率最高。
(3)在废钒催化剂中主要含VOSO4、V2O5,经过粉碎、水浸、过滤得到的滤渣中含有V2O5。向其中加入Na2SO3、H2SO4,经过氧化还原反应,V2O5变为可溶于水的VOSO4,留在滤液中。向滤液中加入KClO3,发生氧化反应反应,得到(VO2)2SO4。在(VO2)2SO4、VO3—、NH4VO3及V2O5中V的化合价都是+5价,化合价不变,所以是非氧化还原反应。因此反应①②③④中属于氧化还原反应的是①② 其中反应③的离子方程式为NH4+ + VO3-=NH4VO3↓ 。根据题目提供的图像可知:控制氯化铵系数是4;温度为80℃ 。这时沉钒率最高。
考点:考查设备的使用、反应条件的选择、化学平衡常数的计算、氧化还原反应的判断及离子方程式的书写的知识。

从海藻灰中可以提取碘的主要反应为:2 I-+Cl2="2" Cl-+I2,下列说法正确的是
| A.该反应属于置换反应 | B.I-具有氧化性 |
| C.1mol氯气转移了1mol电子 | D.Cl2是还原剂 |
在炼铜的过程中发生:Cu2S + 2Cu2O =" 6Cu" + SO2↑,则下列叙述正确的是
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
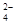 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 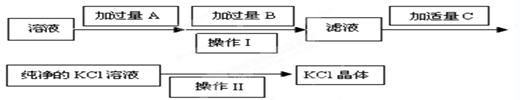
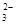 、OH-、HCO
、OH-、HCO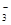 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作: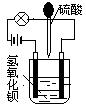
 4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①
4CO(g)+BaS(s)△H1=+571.2kJ?mol-1 ①