题目内容
11.1902年德国化学家哈博研究出合成氨的方法,其反应原理为:N2(g)+3H2(g)?2NH3(g);△H(△H<0)一种工业合成氨的简易流程图如图:
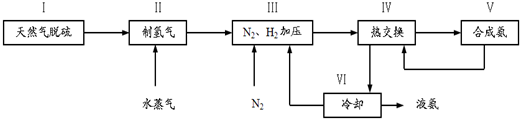
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生.NH4HS的电子式是
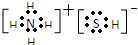 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.(2)室温下,0.1mol/L的氯化铵溶液和0.1mol/L的硫酸氢铵溶液,酸性更强的是NH4HSO4,其原因是HSO4-有较大程度的电离,使溶液呈较强酸性,而NH4Cl只是NH4+水解呈弱酸性.
已知:H2SO4:H2SO4═H++HSO4-; HSO4-?H++SO42- K=1.2×10-2
NH3•H2O:K=1.8×10-5
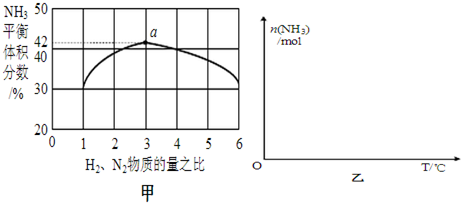
(3)图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:0.145(保留3位有效数字).
(4)依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)Ⅳ.简述本流程中提高合成氨原料总转化率的方法(只答一种即可)分离液氨,未反应的氮气和氢气循环使用.
分析 (1)NH4HS为离子化合物,阴阳离子都需要标出最外层电子及所带电荷;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10-2,非常的大,所以硫酸氢铵溶液的酸性强同浓度的氯化铵;
(3)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
(5)依据反应是气体体积减小的放热反应,结合平衡移动原理分析.
解答 解:(1)NH4HS为离子化合物,其电子式是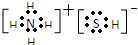 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2=2S↓+2NH3•H2O;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2=2S↓+2NH3•H2O;
;NH3分子间存在氢键,所以NH3的沸点高于H2S,
故答案为: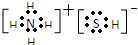 ;2NH4HS+O2=2S↓+2NH3•H2O;分子间作用;
;2NH4HS+O2=2S↓+2NH3•H2O;分子间作用;
(2)硫酸氢铵中的硫氢根离子的电离程度Ki2=1.2×10-2,0.1mol/L的硫酸氢铵溶液中氢离子浓度约为:0.1mol/L×1.2×10-2=1.2×10-3×mol/L,而氯化铵是铵根离子部分水解呈酸性,所以硫酸氢铵溶液的酸性大于同浓度的氯化铵,
故答案为:NH4HSO4;HSO4-有较大程度的电离,使溶液呈较强酸性,而NH4Cl只是NH4+水解呈弱酸性;
(3)依据反应特征N2+3H2=2NH3 △V
1 3 2 2
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为0.145,
故答案为:0.145;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,画出的图象为: ,
,
故答案为: ;
;
(5)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
故答案为:Ⅳ;分离液氨,未反应的氮气和氢气循环使用.
点评 本题考查了化学平衡影响因素分析、平衡计算应用,题目难度中等,注意反应特征的计算应用、图象绘制,试题侧重考查学生灵活应用基础知识的能力.

 名校课堂系列答案
名校课堂系列答案①同分异构体; ②具有相同的最简式; ③乳酸与聚乳酸; ④含氢的质量分数相同⑤苯乙烯和聚苯乙烯 ⑥葡萄糖与淀粉 ⑦甲苯与甘油.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②③④⑤⑦ | D. | ①②④⑤⑦ |
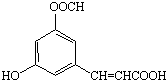
| A. | M有3种不同的官能团 | |
| B. | M可发生取代、加成、消去和聚合等4种有机反应 | |
| C. | 1molM完全燃烧生成CO2和H2O,需要5molO2 | |
| D. | 1molM与足量的NaOH溶液反应,最多需要4molNaOH |
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: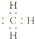 | |
| C. | 乙醇的分子式:C2H4O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{153}$I |
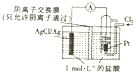
| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
| 序号 | 操作及现象 | 结论 |
| A | 将pH为11的氨水稀释10倍,测量所得pH大于10 | 加水稀释NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 水解程度:CO32->HCO3- |
| C | 镁粉加入NH4Cl溶液中,有刺激性气味气体放出 | 该气体含有NH3 |
| D | 某气体能使酸性KMnO4溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1H和3H | B. | 淀粉和纤维素 | ||
| C. | O2与O3 | D. | CH4与CH3-CH2-CH3 |
 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.