题目内容
13.把3molA气体和2.5molB气体混合放入4L恒容密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+nD(g),经过5min后达到化学平衡,此时生成0.4molC.测得用D表示的平均速率为0.02mol•L-1•min-1.(1)平衡时A的物质的量浓度;
(2)n的值.
分析 (1)根据生成C的物质的量计算消耗A的物质的量,进而计算平衡时A的物质的量,再根据c=$\frac{n}{V}$计算A的平衡浓度;
(2)计算△n=υ•△t•V计算生成D的物质的量,根据物质的量之比等于化学计量数之比计算n的值.
解答 解:(1)平衡时生成0.4molC,由方程式可知消耗A为0.4mol×$\frac{3}{2}$=0.6mol,则平衡时A的物质的量为3mol-0.6mol=2.4mol,故平衡时A的浓度为$\frac{2.4mol}{4L}$=0.6mol/L,
答:平衡时A的浓度为0.6mol/L;
(2)生成D的物质的量为0.02mol•L-1•min-1×5min×4L=0.4mol,则0.4mol:0.4mol=2:n,故n=2,
答:n的值为2.
点评 本题考查化学平衡有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
7.一种气态烷烃和一种气态烯烃的混合物共10g,标况下的密度为1.116g/L.使混合气通过足量溴水,溴水增重8.4g,则混合气中的烃分别是( )
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 乙烷和丙烯 |
8.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A. | 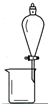 用CCl4提取溴水中的Br2 用CCl4提取溴水中的Br2 | B. |  从KI和I2的固体混合物中回收I2 从KI和I2的固体混合物中回收I2 | ||
| C. | 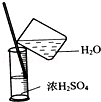 稀释浓硫酸 稀释浓硫酸 | D. | 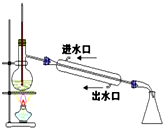 工业酒精制备无水酒精 工业酒精制备无水酒精 |
18.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA | |
| B. | 100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3- | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1molNa2O2中含有的离子数为0.4NA |
2.制取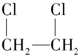 最合理的方法是( )
最合理的方法是( )
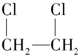 最合理的方法是( )
最合理的方法是( )| A. | CH3CH3与Cl2取代 | B. | CH2═CH2与HCl加成 | ||
| C. | CH2═CH2与Cl2加成 | D. | CH3CH2Cl与Cl2取代 |
3.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 二氧化硫体现还原性,做还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |

 ,NaClO属于离子(离子、共价)化合物.
,NaClO属于离子(离子、共价)化合物.