题目内容
2.制取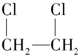 最合理的方法是( )
最合理的方法是( )| A. | CH3CH3与Cl2取代 | B. | CH2═CH2与HCl加成 | ||
| C. | CH2═CH2与Cl2加成 | D. | CH3CH2Cl与Cl2取代 |
分析 A.CH3CH3与Cl2发生取代反应生成的多种氯代乙烷;
B.CH2═CH2与HCl发生加成反应生成氯乙烷;
C.CH2═CH2与Cl2发生加成反应生成1,2-二氯乙烷;
D.CH3CH2Cl与Cl2发生取代反应生成的多种氯代乙烷.
解答 解:A.CH3CH3与Cl2发生取代反应生成产物为乙烷的各种氯代产物,无法获得较纯净的1,2-二氯乙烷,故A错误;
B.CH2═CH2与HCl发生加成反应生成氯乙烷,无法获得1,2-二氯乙烷,故B错误;
C.CH2═CH2与Cl2反应生成产物为1,2-二氯乙烷,获得纯净的1,2-二氯乙烷,故C正确;
D.CH3CH2Cl与Cl2发生取代反应生成的多种氯代乙烷,无法获得较纯净的1,2-二氯乙烷,故D错误;
故选C.
点评 本题考查了有机物的制取方案的评价,题目难度不大,注意掌握常见有机物的结构与性质,能够根据学过的有机反应原理判断制取方案的合理性.

练习册系列答案
相关题目
16.2013年6月,我国“蛟龙”号再次刷新“中国深度”--下潜7062米,为我国深海矿物资源的开发奠定了基础.海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿.
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的.TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+.
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
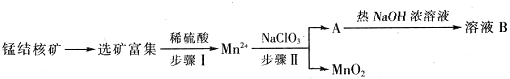
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是氧化亚铁离子.
(2)设计实验证明炉渣中含有FeO取炉渣少许,用稀硫酸浸取后的溶液使KMnO4溶液褪色.
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
则:①m=33.6g ②写出实验②发生反应后溶液中Fe2+与Fe3+物质的量之比为:3:2.
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的.TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+.
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
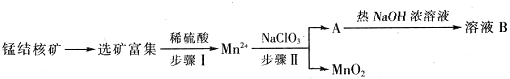
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是氧化亚铁离子.
(2)设计实验证明炉渣中含有FeO取炉渣少许,用稀硫酸浸取后的溶液使KMnO4溶液褪色.
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
10.实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是( )
| A. | 0.50 mol•L-1 盐酸,0.50 mol•L-1 NaOH溶液,100 mL量筒1个 | |
| B. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,100 mL量筒2个 | |
| C. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒1个 | |
| D. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒2个 |
17.下列化学实验操作或事故处理方法不正确的是( )
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| C. | 酒精灯着火时可用沙子扑灭 | |
| D. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
11.下列溶液中离子一定能够大量共存的是( )
| A. | 使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- | |
| B. | 无色透明的溶液中:Ba2+、H+、MnO4-、Br- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
12.下列有关物质转化的叙述不正确的是( )
| A. | SiO2→H2SiO3、CuO→Cu(OH)2、CuSO4→CuCl2均不能通过一步反应实现 | |
| B. | FeS、FeCl2、Fe(OH)3均可以通过化合反应制得 | |
| C. | 水在化学反应中可能只做氧化剂、或只做还原剂、或既不做氧化剂也不做还原剂、或既做氧化剂又做还原剂 | |
| D. | 在某一复分解反应中,也有可能弱酸是反应物,而强酸是生成物 |

 .
.