题目内容
18.若NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA | |
| B. | 100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3- | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1molNa2O2中含有的离子数为0.4NA |
分析 A.铁与氯气反应生成的是氯化铁,0.1mol氯气得到0.2mol电子;
B.碳酸氢根水解生成碳酸;
C.氯气与氢氧化钠发生歧化反应,氯从0价的单质氯变成-1价的NaCl中的氯,氯从0价的单质氯变成+1价的NaClO中的氯;
D.Na2O2由2个Na+和1个O22-构成.
解答 解:A.0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA,故A正确;
B.100mL 1mol/L NaHCO3溶液含有HCO3-个数少于0.1NA,故B错误;
C.氯气与氢氧化钠反应:Cl2+2NaOH=NaCl+NaClO+H2O,1mol氯气完全反应,氯从0价的单质氯变成+1价的NaClO中的氯,失去1mol电子,氯从0价的单质氯变成-1价的NaCl中的氯,得到1mol电子,7.1gCl2为0.1mol,转移0.1NA电子,故C错误;
D.Na2O2由2个Na+和1个O22-构成,故0.1molNa2O2中含有的离子数为0.3NA,故D错误.
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意铁参加反应生成产物中铁元素的化合价情况,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,既要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
12.乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产.回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式CH2=CH2+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:
甲醇脱水反应①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9KJ•mol-1
甲醇制烯烃反应②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1KJ•mol-1
乙醇异构化反应③CH3CH2OH(g)═CH3OCH3(g)?△H3=+50.7KJ•mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)═C2H5OH(g)的?△H=-45.5KJ•mol-1
与间接水合法相比,气相直接水合法的优点是:无副产品,原子利用率100%.
(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+
6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol,在一定压强下,测得该反应的实验数据如下表.
请根据表中数据分析:上述反应的a小于0(填“大于”或“小于”
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量不变(填“增大”、“减小”或“不变”).
③增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值,则生成乙醇的物质的量不能确定(填“增大”、“减小”、“不变”或“不能确定”).
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H).再水解生成乙醇.写出相应的反应的化学方程式CH2=CH2+H2SO4=C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4.
(2)已知:
甲醇脱水反应①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9KJ•mol-1
甲醇制烯烃反应②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1KJ•mol-1
乙醇异构化反应③CH3CH2OH(g)═CH3OCH3(g)?△H3=+50.7KJ•mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)═C2H5OH(g)的?△H=-45.5KJ•mol-1
与间接水合法相比,气相直接水合法的优点是:无副产品,原子利用率100%.
(3)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+
6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol,在一定压强下,测得该反应的实验数据如下表.
| 温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量不变(填“增大”、“减小”或“不变”).
③增大$\frac{n({H}_{2})}{n(C{O}_{2})}$的值,则生成乙醇的物质的量不能确定(填“增大”、“减小”、“不变”或“不能确定”).
6. 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| I | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.9mol | - |
| A. | 实验I中,lOmin 内平均速率v(B)=0.06mol•L-1•min-1 | |
| B. | 600℃时,上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 800℃时,在原容器中充入 1molA、0.5molB、1molC、0.5molD,则v(正)<v(逆) |
3.能正确表示下列反应的离子方程式是( )
| A. | 向NaOH溶液中通入过量的CO2:CO2+OH-═HCO3- | |
| B. | 将SO2气体通入Ba(NO3)2溶液:SO2+H2O+Ba2+═BaSO3↓+2H+ | |
| C. | 实验室制氯气:MnO2+4HCl(浓)═Mn2++2Cl2↑+2H2O | |
| D. | AlCl3溶液与过量氨水混合:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
10.实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是( )
| A. | 0.50 mol•L-1 盐酸,0.50 mol•L-1 NaOH溶液,100 mL量筒1个 | |
| B. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,100 mL量筒2个 | |
| C. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒1个 | |
| D. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒2个 |
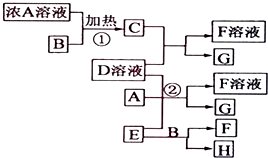 以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如图转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.