题目内容
1.湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙烧获得活性氧化锌,其化学工艺流程如下: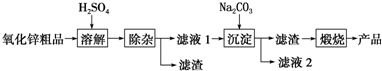
(1)若检验流程中滤液2中含有Na+,则实验的具体操作是将铂丝蘸盐酸在无色火焰上灼烧至无色,再蘸取待测溶液在无色火焰上灼烧,观察火焰颜色,再将铂丝再蘸盐酸灼烧至无色
(2)上述流程如图中若在常温下,pH=12的Na2CO3溶液中c(CO32-)=0.50mol/L,c(HCO3-)=1×10-2 mol/L,则c(Na+):c(OH-)=102:1.
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(4)已知常温下Cu(OH)2的Ksp=2×10-20.溶液中杂质Cu2+浓度为0.02mol•L-1,若要生成沉淀,则应调节溶液的pH大于5.
(5)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
分析 由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,以此检验;
(2)pH=12的Na2CO3溶液,n(Na)=2n(C),c(OH-)=0.01mol/L;
(3)Fe2+、Cu2+等杂质,均可与碳酸钠反应;适量KMnO4将Fe2+转化为Fe(OH)3,由电子守恒计算;
(4)Cu2+浓度为0.02mol•L-1,转化为沉淀时c(OH-)=$\sqrt{\frac{Ksp}{c(Cu{\;}^{2+})}}$;
(5)根据煅烧反应生成ZnO、二氧化碳和水,利用质量守恒配平.
解答 解:由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,则检验溶液中含有Na+,常用焰色反应,具体操作是:将铂丝蘸盐酸在无色火焰上灼烧至无色,再蘸取待测溶液在无色火焰上灼烧,观察火焰颜色,再将铂丝再蘸盐酸灼烧至无色;
故答案为:将铂丝蘸盐酸在无色火焰上灼烧至无色,再蘸取待测溶液在无色火焰上灼烧,观察火焰颜色,再将铂丝再蘸盐酸灼烧至无色;
(2)pH=12的Na2CO3溶液,由化学式可知,n(Na)=2n(C),则c(Na+)=2×0.51 mol/L=1.02 mol/L,c(OH-)=0.01mol/L,所以c(Na+):c(OH-)=102:1;
故答案为:102:1;
(3)溶解后得到酸性溶液,要调节溶液的pH至5.4,需要升高pH,故应加入Na2CO3 n(Fe2+)=0.009 mol,由电子得失守恒,则n(KMnO4)=$\frac{0.009mol}{(7-4)}$=0.003mol;
故答案为:Na2CO3;0.003;
(4)Cu2+浓度为0.02mol•L-1,c(Cu2+)•[c(OH-)]2=2×10-20时,开始出现沉淀,c(OH-)=$\sqrt{\frac{Ksp}{c(Cu{\;}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=10-9mol•L-1,pH=5,即若要生成沉淀,则应调节溶液的pH大于5;
故答案为:5;
(5)“煅烧”反应生成ZnO、二氧化碳和水,反应方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑;
故答案为::ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
点评 本题考查学生对工艺流程的理解,涉及物质的性质与制备、物质的检验等知识,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,难度中等.

Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的.TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+.
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
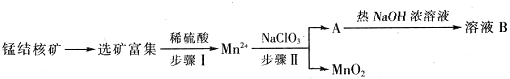
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑.
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠.
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;
(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3
根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是氧化亚铁离子.
(2)设计实验证明炉渣中含有FeO取炉渣少许,用稀硫酸浸取后的溶液使KMnO4溶液褪色.
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
| A. | 工业制取硝酸时尾气用氢氧化钠溶液吸收 | |
| B. | 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻到安全区域 | |
| C. | 家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体 | |
| D. | 家中发生天然气泄露时,应立即使用室内电话报警 |
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1.实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| I | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.9mol | - |
| A. | 实验I中,lOmin 内平均速率v(B)=0.06mol•L-1•min-1 | |
| B. | 600℃时,上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 800℃时,在原容器中充入 1molA、0.5molB、1molC、0.5molD,则v(正)<v(逆) |
| A. | 0.50 mol•L-1 盐酸,0.50 mol•L-1 NaOH溶液,100 mL量筒1个 | |
| B. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,100 mL量筒2个 | |
| C. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒1个 | |
| D. | 0.50 mol•L-1 盐酸,0.55 mol•L-1 NaOH溶液,50 mL量筒2个 |
| A. | 使甲基橙变红的溶液中:NH4+、NO3-、Na+、SO42- | |
| B. | 无色透明的溶液中:Ba2+、H+、MnO4-、Br- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32- | |
| D. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
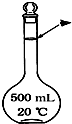 实验室配制500mL0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL0.5mol•L-1的NaCl溶液,有如下操作步骤: